






















3. Технологическая часть
3.1. Теоретические основы процесса
В настоящее время конверсия метана и его гомологов является основным промышленным методом получения водорода и технологических газов для синтеза аммиака, спиртов, моторных топлив и других продуктов.
В процессе конверсии метан окисляется водяным паром, диоксидом углерода или кислородом по следующим основным реакциям:
СН4 + Н2О « СО + 3Н2 – 206,4 кДж/моль (3.1)
СН4 + СО2 « 2СО + 2Н2 – 248,3 кДж/моль (3.2)
СН4 + 0,5О2 « СО+2Н2 + 35,6 кДж/моль(3.3)
СО + Н2О « СО2 + Н2О + 41,0 кДж/моль (3.4)
Реакции окисления гомологов метана протекают аналогично. Так, взаимодействие их с водяным паром может быть в общем виде выражено уравнением:
СnНm + nН2O = nСО + 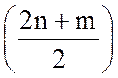 Н2
Н2
При получении азотоводородной смеси для синтеза аммиака необходимое количество азота вводят с воздухом на стадии конверсии углеводородных газов либо при промывке конвертированного газа жидким азотом для удаления остатков оксида углерода.
Для проведения в промышленных условиях сильно эндотермических реакций (3.1) и (3.2) требуется подвод тепла извне. При добавлении кислорода протекает экзотермическая реакция (3.3), что позволяет осуществить процесс конверсии углеводородных газов автотермично [ 2].
Термодинамическое равновесие конверсии метана
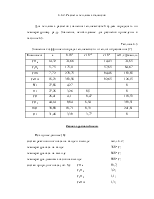
Ниже даны выражения констант равновесия реакций (3.1)-(3.4).
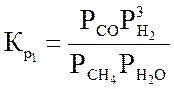 ;
; 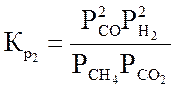 ;
; 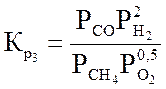 ;
; 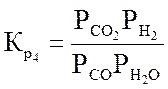
![]() ,
,
![]() ,
, ![]() ,
, ![]() ,
, ![]() – парциальные давления
компонентов.
– парциальные давления
компонентов.
Состав конвертированного газа определяется положением равновесия независимых реакций (3.1) и (3.4).
Реакция (3.2) является производной, а реакцией (3.3) можно пренебречь, так как константа ее равновесия, в интервале температур 327-1127 °С настолько велика, что концентрация непрореагировавшего кислорода в равновесной газовой смеси практически равна нулю.
В расчетах принимается, что все газы являются идеальными, а добавляемый кислород реагирует с водородом с образованием водяного пара.
Зависимости констант равновесия от температуры (Т в К) могут быть представлены в виде полиномов [1]:
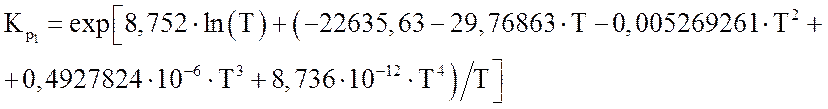 (3.5)
(3.5)
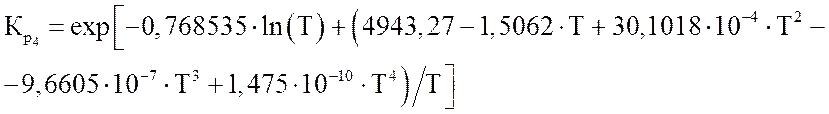 (3.6)
(3.6)
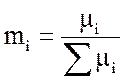 (3.7)
(3.7)
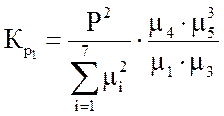 ;
; 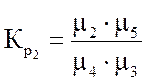 (3.8)
(3.8)
где m – мольные доли компонентов; 1 – СН4; 2 – СО2; 3 – Н2О; 4 – СО; 5 – Н2.
На основе известных методик через мольные доли всех компонентов, участвующих в реакциях (3.1) и (3.4), ведут расчет равновесных составов конвертированного газа при различных значениях давления (в МПа), соотношениях пар:газ и температурах реакций. На основе расчетного массива данных строят номограммы зависимости содержания отдельных компонентов в конвертированном газе [1, 2].
Ниже приведены реакции взаимодействия некоторых высших алифатических углеводородов с водяным паром и гидрирования их с образованием метана:
С2Н6 + 2Н2О = 2СО + 5Н2 – 347,5 кДж (3.9)
С3Н8 + 3Н2О = 3СО + 7Н2 – 498,2 кДж (3.10)
С2Н4 + 2Н2О = 2СО + 4Н2 – 226,5 кДж (3.11)
С3Н6 + 3Н2О = 3СО + 6Н2 – 406,1 кДж (3.12)
С2Н6 + Н2 = 2СН4 + 65,3 кДж (3.13)
С3Н8 + 2 Н2 = ЗСН4 +121,0 кДж (3.14)
Численные значения констант равновесия реакций (3.9)-(3.12) в интервале температур 327-827 °С намного выше констант равновесия реакций конверсии метана водяным паром (3.5). Как показали термодинамические расчеты, при добавлении водяного пара в двукратном количественно сравнению со стехиометрическим) гомологи метана и олефины практически полностью конвертируются при 400-500 °С. Однако реакция (3.1) при этих температурах в значительной мере протекает справа налево с синтезом метана из СО и Н2, образовавшихся по реакциям (3.9)-(3.12) [1].
Метан образуется также в результате гидрирования высших алифатических углеводородов по реакциям (3.13) и (3.14). Показано, что на промышленном никелевом катализаторе ГИАП-3 при небольшом (по сравнению со стехиометрическим количеством) избытке водорода, температуре около 400 °С и времени контакта 0,5-1 с технический пропан, н-гексан и этилен практически нацело превращаются в метан. При гидрировании этилена вначале образуется этан, а затем метан [2-5].
При конверсии этана, пропана, бутана и олефинов водяным паром на никелевом катализаторе при температуре 600 °С и выше в продуктах реакции из углеводородов был обнаружен только метан. Поэтому равновесный состав газа, получаемого конверсией любых алифатических углеводородов при указанной температуре, можно определить, исходя только из констант равновесия реакций (3.1) и (3.4).
По разработанной методике содержание углеводородов в исходном газе следует при этом выразить эквивалентным количеством метана и учесть расход водорода на гидрирование высших углеводородов.
Двухступенчатая паровая и паровоздушная конверсия метана
Обычная схема. Результаты проведенных термодинамических расчетов процесса паровой и парокислородной конверсии метана рассматривались самостоятельно без учета возможности получения комплексных уравнений [1].
При осуществлении последовательного двухступенчатого процесса, в котором на первой ступени (трубчатая конверсия) протекает паровая конверсия, а на второй паровоздушная (шахтная доконверсия) состав конвертированного газа на выходе из шахтного конвертора определяется составом, давлением и температурой конвертированного газа на выходе из трубчатой печи, который перед шахтным конвертором смешивают с воздухом.
Расчет состава продуктов реакции после трубчатых печей и шахтного конвертора проводят по уравнениям двух основных реакций (3.1) и (3.4) и уравнению теплового баланса шахтного конвертора [1-5].
Для расчета следует задать: остаточное содержание метана в сухом газе; соотношение (Н2+СО):N2 по объему; температуре реакционной смеси на выходе из трубчатой печи; потери тепла в шахтном конверторе и потери тепла в трубопроводе между трубчатой печью и шахтным конвертором.
При расчете определяют: состав конвертированного газа; соотношение пар:газ на входе в трубчатую печь; температуру конвертированного газа после шахтного конвертора и соотношение природный газ : технологический воздух [2-5].
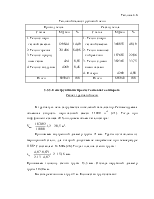
Согласно методике расчета 2-ступенчатой конверсии вначале определяют состав исходной парогазовой смеси с учетом добавления азотоводородной смеси и реакций гидрирования высших углеводородов. Затем для заданной равновесной температуры на выходе из стадии паровой конверсию рассчитывают состав конвертированного газа из условий равновесия по ранее описанной методике. Константы равновесия реакций конверсии газа определяют по уравнениям (3.5) и (3.6), тепло, подводимое к реакционным трубам, – из разности энтальпий компонентов на выходе из реактора и на входе в него.
При определении параметров работы шахтного конвертора рассчитывают состав и температуру газа на выходе из него. Задавая температуру газа на выходе из шахтного конвертора, находят состав газа. После этого проверяют сходимость теплового баланса. В этом случае теплосодержание смеси газов на входе в шахтный конвертор должно равняться сумме теплосодержаний компонентов смеси на выходе и тепловых потерь [1].
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.