15. Переработка оксидов азота в азотную кислоту.Кинетика, равновесие процесса. Вывод уравнения для расчёта равновесного состава оксидов азота над растворами азотной кислоты, расчёт с применением этого уравнения. Уравнение длярасчёта к.п.д.тарелки.
Механизм переработки NOх в HNO3 сложен. Оксиды азота взаим-ют с водой по р-м: 2NO2г+H2Oж=HNO3р+HNO2р, DН=-116 (1) N2O4г+H2Oж=HNO3р+HNO2р, DН=-59кДж (2); N2O3г+H2Oж=HNO2р, DН=-56кДж (3). Реакции 1-2 идут с выс скоростью. HNO2 - малоустойчивое соединение и поэтому распадается на HNO3 и NO:
3HNO2р= HNO3р+2NO+H2Oж, DН=75,8 (4). Скорость этой реакции невелика. Из предыдущ уравнений следует, что для переработки NOх в HNO3 необх-о ↓ температуру, а для разложения HNO2 - ↑ ее, поэтому на практике главную роль в ускорении распада HNO2 играет интенсивное перемешивание раствора на тарелке и окис-е HNO2 в жид фазе растворенным кислородом по р-и: 2HNO2р+O2㬮 2HNO3ж, DН=-8,96(5);
Завависимость скорости р-и (4) от температуры выражается уравнением: lgk=-6250/T+22.65. Суммарная реакция образ-я АК склад-ся из ур-й (1-4) и имеет вид: 3NO2г+H2Oж=2HNO3г+NOг, DН=-136,2 (6). Таким оброзом в АК превращ-ся только 2/3 NO2, а 1/3 возвращ-ся в газовую фазу в виде вторичного оксида азота (II). Это создает значительные сложности при техническом оформлении процесса. Требуется абсорбционная колонна с большим кол-вом тарелок и объемными межтарельчатыми расстояниями для гомогенного окисления вторичного NO по р-и 2NO+O2 ¬® 2NO2, -114 (7). Из уравнений р-и 4NH3+5O2=4NO+6H2O, DН=-907 (8), (6 и 7) следует, что давление по-разному влияет на процессы окисления NH3 и переработки NОх в кислоту. Реакция (8) идет с ↑ V, поэтому давление на стадии окисления целесообразно ↓. Реакции (6 и 7) проходят с ↓ V, поэт для глубокой переработки NOх давление необходимо ↑. Константу равнения реакциии (6) K= PNO* PHNO32/ PNO23*PH2O, целесообразно рассматривать как произведение 2-х частных const К=K1*K2, где K1= PNO / PNO23 K2= PHNO32/PH2O. Удобнее расчет вести по K1. Расчет в интервале температур 20-80ºС и СHNO3=40-70% мас. выполняется по уравнению: зав-ть lgK1=f(t, СHNO3).
Процесс абсобции осуществляется в многотарельчатой абсорбционной колонне. Перерабеработка NOх в HNO3 происисходит в ГЖ-м слое ситчатых тарелок в абс колонне. На тарелку поступает НГ (смесь NO,NO2,N2O4,O2,N2).
Для расчета эффективности процесса переработки оксидов азота на тарелке необходимо знать предельные т.е равновесные значения парциальных давлений NO, NO2, и N2O4 которые лишь теоритически возможны при данных температуре и начальных pNO, pNO2, pN2O4.
Метод расчета равеовесн-го состава NOх над р-ми HNO3 основан на р-циях: 3NO2+Н2ОÛ2НNO3+NO(А), тогда K1= PNO / PNO23 PNO = K1* PNO23
2NO2ÛN2O4(В), тогда K3= PNO22 / PN2O4 PN2O4= PNO22 / K3
Обоз-м – а,в,с–парц.давл-я компон-в в исх-м газе; х – конечное парц.давл-ие NO2.
Выр-м с помощью const равновесия равнов-е парц. давл-я NO и N2O4:
Согл-но (А) кол-во образ-ся NО в 3 раза меньше кол-ва погл-ного NO2.
|
Компонент |
Парц. давл-я |
|
|
в исходн газе |
В равновесн газе |
|
|
NO |
а |
К1*х3 |
|
NO2 |
в |
х |
|
N2O4 |
с |
х2/К3 |
Обоз-м суммар-ое парц-ое давл-е высших оксидов азота (NО и NO2) как РNO2(с), тогда пос-ку N2O4Û2NO2, общее РNO2(с) без уч димеризации NO2 м. рассм-ть как РNO2+2 РN2O4, тогда убыль NO2 при поглащ-и равна: ''в-х'', но (в-х)/3 равно: (в-х)/3 = К1х3 – а, откуда в-х = 3(К1х3 – а) (С). С др стороны убыль NO2 равна: в-х = (в+2с)-(х+2х2/К3) (Д). Прирав-я (С) и (Д) пол-м: 3К1х3+2х2/К3+х= 3а +в+2с. Решив это ур-е, относ-но х=РNO2, д/изв-х К1 и К3, пол-м равн-ые парц-ые давл-я РNO и РN2O4.
Кинетика взаимодествия NOх с водными растворами АК представляет собой сложный массообменный прецесс. Скорость взимодействая зависит от физико-химических и гидродинамических условий абсорбции. Скорость процесса удовлетворительно описывается уравнением массопередачи: V=K*(Dp-p/); где V- скорость поглощения NOх ( в пересчете на HNO3), кг/м2ч; К- коэф. массопередачи, кг/м2ч*МПа; Dp- сред. движ. сила пр-са, МПа; p/ - фактор учит-щий насыщение ж.ф. оксидами азота.
В пром. условиях скорость абс-ции лимитируется скоростью диффузии.
КПД Эф-ть пр-са массопер-и опред-ся коэф-том полез д-я, т е степению достиж-я равновесия м/у NOх и р-ром HNO3 на тарелке по фор-е: h=(рн-рк)/ рн-рр где рнрк рр -парц Р-е NOх соответ-о на входе на тар, выходе из нее и равновесное.
Величина h при расчетах опред: h=(8,73*Р0,15*СNOх0,1*a0,4Н0,15СHNO30,1/W0.26d10.15S0.13T0.87). где Р - общее Р-е г, атм; СNOх-общая конц-я NOх в НГ; a-степ-нь окисленности NOх, доли ед; Н- высота перелива ж-ти на тар,м; СHNO3-конц-я HNO3,% мас; W- ск-ть газа в полом сеч-е колонны, м/с; d - д-р отв-й ситчатой тар, м; S-доля своб сеч-я тар, доли ед; Т - т-ра р-ра на тар, К.
44.Интерпретация зависимости превращения реагента от Т при протекании эндотермической и экзотермической обратимой каталитической реакции.
В соот-и с принц Ле-Шат-е, если на систему, наход-ся в равнов-ии воздейств-ть извне путем измения какого-либо условия определяющего полож-е равновесия, то в этой системе усилится такой процесс, течение которого ослабляет влияние произведенного воздействия. При этом полож-е равнов-я сместится в соотв-м направл-и. Если протек-т обрат экзотер-я реакц-я, то за счет выделяющегося тепла повышается температура реакционной смеси, равновесие сдвиг-ся влево и равнов-я конц-я целевого прод-та уменьшается. Для того, чтобы этого не произошло, необход-о отводить тепло. Для обратим эндотерм-й реакц-, протек-й с поглащ-м тепла необходимо наоборот подводить тепло.
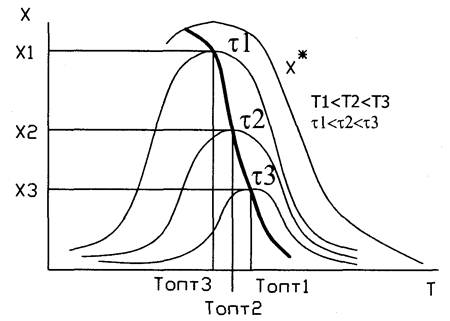
Для обрат экзот-й реакции завис-ть Х=f(T) при некот времени t вначале возрастает, достиг-т макс-го значения, а затем снижается, поскольку процесс ограничен равнов-й степ превр-я. Кривая, соедин-я макс-мы, отражает зав-ть Х=f(T) и является ЛОТ. Она показ-т, что сущ-т температур-я послед-ть, обеспеч-щая макс-ю ск-ть процесса.
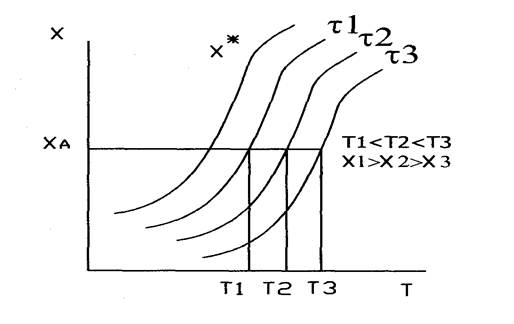
Для оратим-й эндотермич реакц-и вопрос о влиянии температуры решается однозначно. Отсутствие экстремум-в говорит об отсутствии оптимал тем-р, а за критерий оптимизации приним-т экономические факторы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.