


































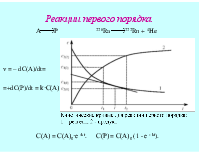




Учебная дисциплина химия
Для специальности 060800 – экономика и управление на предприятии (по отраслям) Курс, рассчитанный на 150 часов, предполагает: ü - усвоение студентами фундаментальных понятий и идей современной химии; ü - освоение методологии этой науки и ее научного языка; ü - представление об особенностях различных новейших наукоемких технологий и перспективах их развития. Для контроля за усвоением материала учебным планом предусмотрено выполнение контрольной работы.
Тематический план учебной дисциплины Химия
Список основной и дополнительной литературы
Интернет-сайты по химии
www.chemnet.ru - портал хим.факультета МГУ www.inorg.chem.msu.ru – в разделе учебной литературы есть учебник Коренева-Овчаренко по общей и неорганической химии (pdf). hemi.wallst.ru – учебник Мануйлова “Основы химии”. rushim.ru – учебники по химии в формате djvu www.college.ru - материалы диска “Открытая химия 2.5”: курс, задачи, биографии, история и т.д.
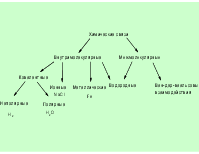
Химия
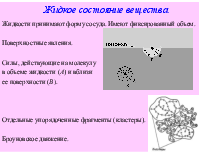
Вещество
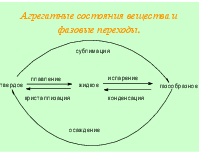
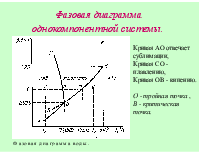
Вещество - вид материи, который обладает массой покоя и состоит из элементарных частиц. Химическим веществом можно назвать однородное тело, имеющее постоянные свойства, не связанные с приданной ему формой или размером. Индивидуальное химическое вещество характеризуется набором физических констант. При физических процессах состав и строение вещества не меняются. В ходе химических реакций исходные вещества превращаются в другие, отличающиеся по составу и строению. Эти процессы подчиняются законам сохранения энергии, массы, электрического заряда, момента количества движения.
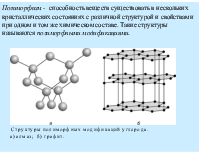
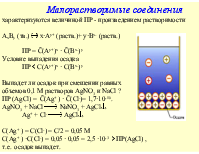
По структурной организации вещества выделяют атомы, молекулы или ионы. Атом - мельчайшая частица вещества, которую химическим путем невозможно разделить на составные части, превратить друг в друга или уничтожить. Молекула – микрочастица из 2 или более атомов, соединенных в единое целое химическими связями, способная к самостоятельному существованию. Ион – одно или многоатомная частица, несущая электрический заряд. Положительно заряженные ионы называются катионами, отрицательно заряженные – анионами. 1 моль – единица количества вещества, содержит 6·1023 частиц.
Строение атомов
Атомы состоят из элементарных частиц. Протон: mp = 1,673·10-27 кг, электрический заряд е = +1,6·10-19 Кл. Нейтрон: mn = 1,675·10-27 кг, не имеет электрического заряда. Протоны и нейтроны входят в состав атомных ядер. Размер ядра составляет ~10-4 от диаметра атома, и в нем сосредоточена основная масса атома. Электрон: me = 9,1·10-31 кг, электрический заряд е = -1,6·10-19 Кл. Электроны находятся в околоядерном пространстве. Относительная атомная масса - безразмерная величина, показывающая, во сколько раз масса данного атома больше 1/12 массы атома 12С. Ar = mi / (m(12C)/12).
Совокупность атомов с одинаковым зарядом ядра называется химическим элементом. Атомы одного химического элемента, различающиеся по количеству нейтронов в ядре, называются изотопами. Изотопы одного химического элемента в химических реакциях ведут себя практически одинаково, но отличаются по физическим свойствам.
Понятие об атомных орбиталях.
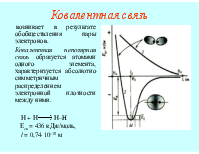
Электроны в атоме подчиняются принципу неопределенности Гейзенберга. Поэтому точно определить положение электрона в атоме невозможно, можно лишь вычислить математическую вероятность его нахождения в определенной точке пространства, которая рассчитывается из решения волнового уравнения Шредингера. Область пространства, в которой вероятность обнаружить электрон
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.