Молекула микрочастица из двух или более атомов, соединенных в единое целое химическими связями, способная к самостоятельному существованию. Молекулы имеют постоянный (качественный и количественный) состав, обладают определенной совокупностью физических и химических свойств. Строение и состав молекулы передаются химической формулой. эмпирическая формула – H2O, C2H6O; молекулярная формула – H2O, CH3OCH3 и C2H5OH - изомеры; структурная формула –
Закон постоянства состава вещества: каждое химическое соединение с молекулярной структурой независимо от способа его получения имеет один и тот же элементный состав. Относительная молекулярная масса определяется Mr = NiAri. Закон кратных отношений: если любые два элемента образуют друг с другом несколько соединений с молекулярной структурой, то массовые количества одного элемента, соединяющиеся с постоянным массовым количеством другого, относятся между собой как небольшие целые числа.
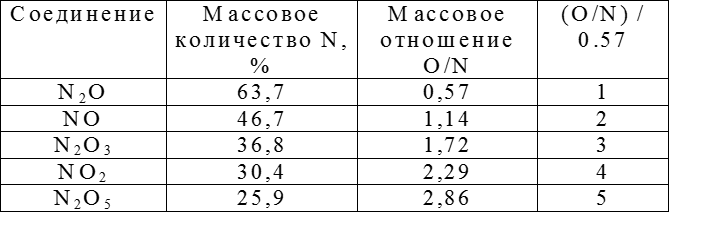
КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
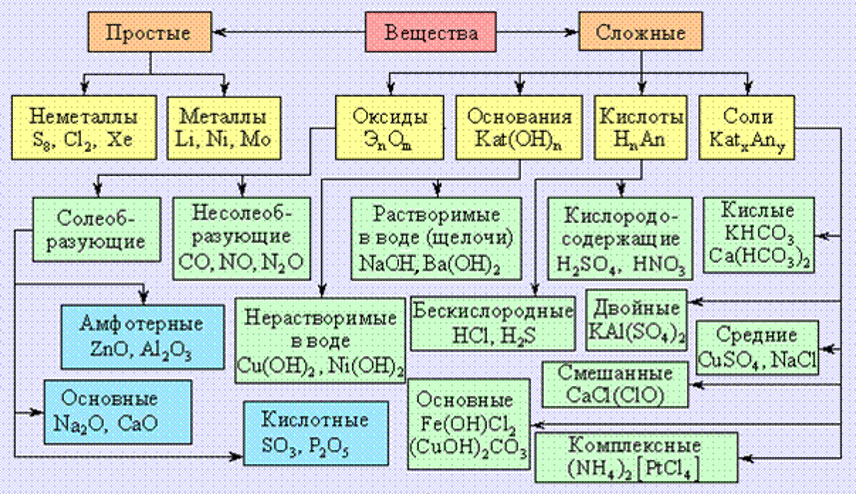
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
ОХ. мод. 12.1., 12.2., 12.3., 12.4

ХИМИЧЕСКИЕ СВЯЗИ (Г.Ю. гл.5,6, Гл. гл.4)
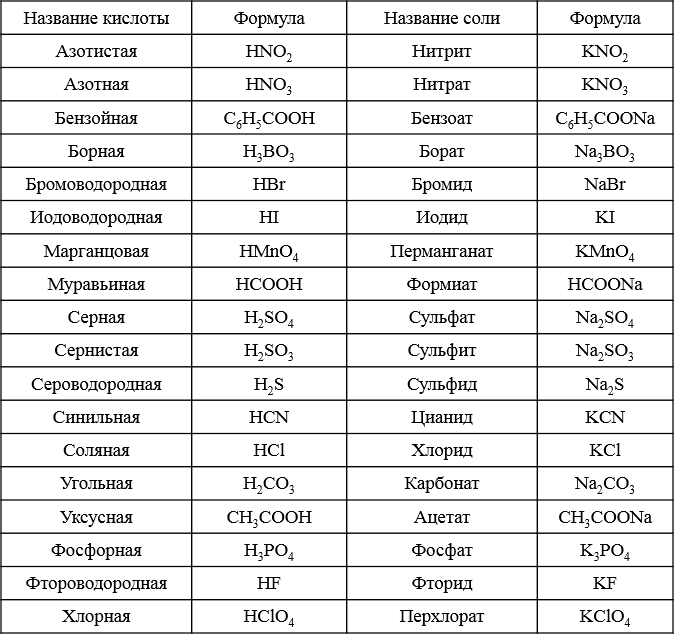
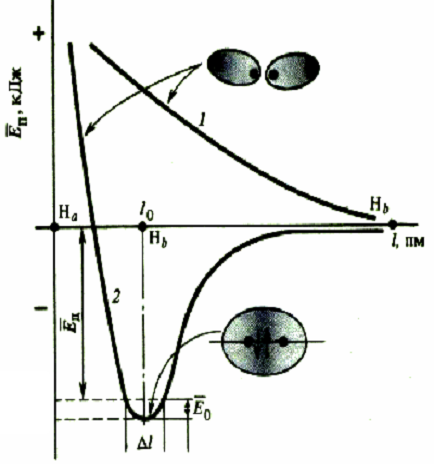
Основа химической связи - перераспределение электронной плотности между связанными в одну структуру атомами. Химическая связь возникает, если в результате образуется соединение с меньшей энергией, чем у исходных частиц. Химические связи характеризуются: 1. Длиной связи.(нм или Ангстрем) 2. Валентным углом. 3. Энергией связи. (кДж/моль) 4. Кратностью связи. По этому критерию связи бывают одинарными, двойными или тройными.
Классификация химических связей по распределению электронной плотности
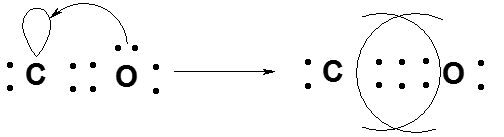
КОВАЛЕНТНАЯ СВЯЗЬ возникает в результате обобществления валентных электронов взаимодействующих атомов.

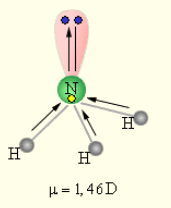
КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ образуется в гетероатомных молекулах, в которых электронная плотность смещена в сторону одного атома, последний приобретает эффективный отрицательный заряд. +H Cl- ( = 0,19 а.е.з.) Дипольный момент – произведение заряда диполя q на расстояние между полюсами r. Измеряется в Кл·м и в единицах Дебай, 1 D = 3,33·10-30 Кл·м. Молекулы, имеющие постоянный дипольный момент, называются полярными. Определить эффективный заряд (в единицах заряда электрона) на атоме фтора в молекуле HF, если известно, что ее дипольный момент равен 1,91 D, а длина связи составляет 0,92·10-10 м.
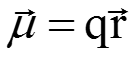

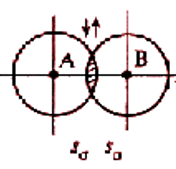
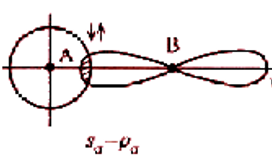
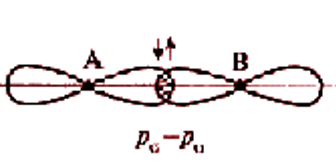
Два механизма образования ковалентной связи
Обменный механизм: происходит спаривание двух электронов с противоположными спинами, принадлежащих разным атомам. Донорно-акцепторный механизм: связь образуется за счет электронной пары одного атома – донора и вакантной орбитали второго атома – акцептора. Изобразить электронную структуру молекул N2, H2S, CS2, H2O2, C2H5OH.
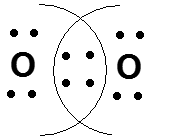
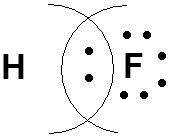

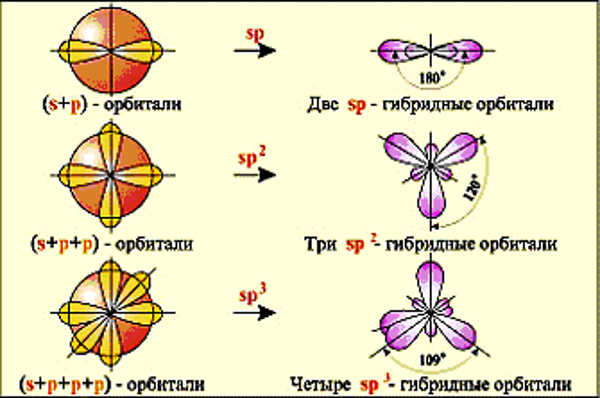
ОБРАЗОВАНИЕ ГИБРИДНЫХ ОРБИТАЛЕЙ В АТОМЕ УГЛЕРОДА. ОХ. мод. 3.3. и 3.4.
Гибридизация - смешение орбиталей разных типов (s, p, d) у одного атома. С 1s22s22р2 С* 1s22s12р3. СН4
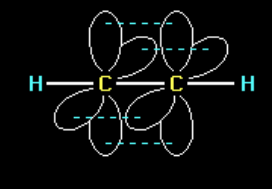
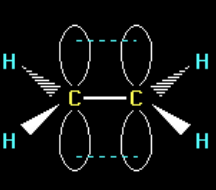
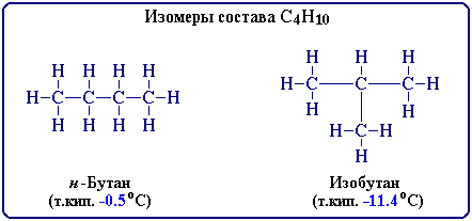
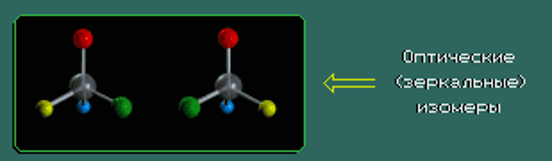
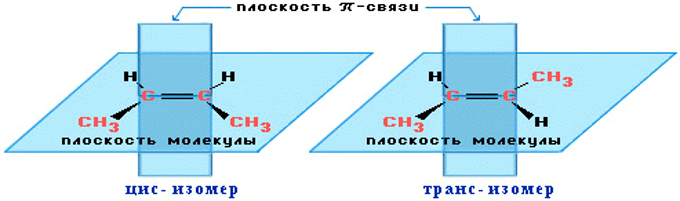
ИЗОМЕРИЯ
явление, заключающееся в существовании веществ, одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и вследствие этого по физическим и химическим свойствам.
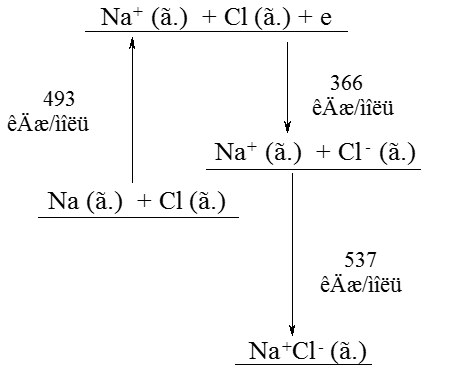
ИОННАЯ СВЯЗЬ Образуется между ионами противоположного знака. Na+Cl-
Na [Ne]3s1, Cl [Ne]3s23p5. ЕI(Na) = 493 кДж/моль; A(Cl) = 366 кДж/моль ; Eион = – NA k·| Z1·Z2 | ·qe2·(1-1/a) / r, где k = 9·109 Дж·м/Кл2, NA – постоянная Авогадро, Z1и Z2 – заряды ионов, qе – заряд электрона, r – межионное расстояние, 2,36·10-10 м, a – коэффициент, учитывающий электронное отталкивание, 12. Есв (NaCl) = EI (Na) – A (Cl) + Еион = – 410 кДж/моль. Рассчитать энергию образования молекулы гидрида лития, если известно, что энергия ионизации лития составляет 517 кДж/моль, сродство к электрону атома водорода – 72 кДж/моль, межионное расстояние равно 1,62·10-10 м, коэффициент отталкивания а принять равным 5.
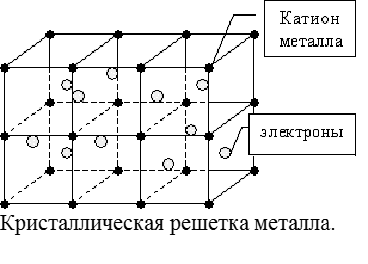
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ образуется в металлических кристаллах в результате обобществления валентных электронов всеми атомами металла. В результате взаимодействия огромного количества атомных орбиталей образуются непрерывные зоны разрешенных энергетических состояний: валентная зона и зона проводимости. Наличие электронов в зоне проводимости обуславливает высокую тепло- и электропроводность металлов.
Межмолекулярные взаимодействия
Водородная связь – взаимодействие между связью Н-Х (Х=N, O, F) и неподеленной парой электронов другого атома Х. Образуется по донорно-акцепторному механизму. Н2О lков = 0,99·10-10 м, Еков = 464 кДж/моль, lвод= 1,77·10-10 м. Евод = 25 кДж/моль.
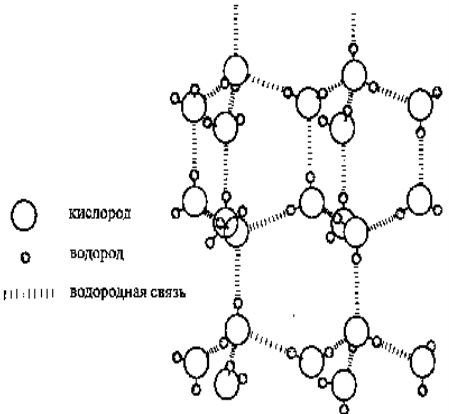
Структура льда.
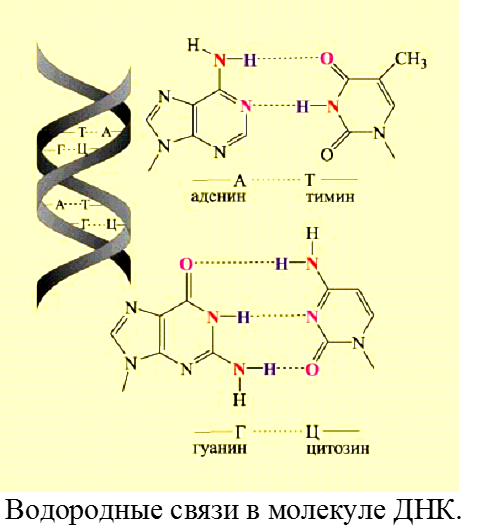
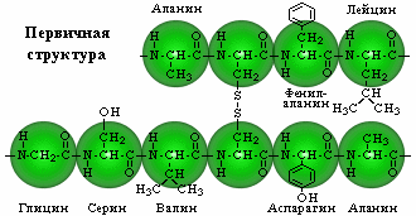
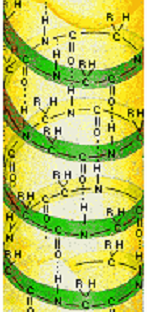

ОХ. мод.13.3.
Водородные связи в белке.
ВАН-ДЕР-ВААЛЬСОВЫ ВЗАИМОДЕЙСТВИЯ

электростатическое взаимодействие молекул с насыщенными химическими связями. наиболее существенны для веществ в твердом или жидком состояниях Выделяют: ориентационное, индукционное и дисперсионное взаимодействия.
ЯН ДИДЕРИК ВАН-ДЕР-ВААЛЬС (1837–1923)
Ван-дер-ваальсовы взаимодействия



Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.