МОДЕЛЬ АТОМА ВОДОРОДА.
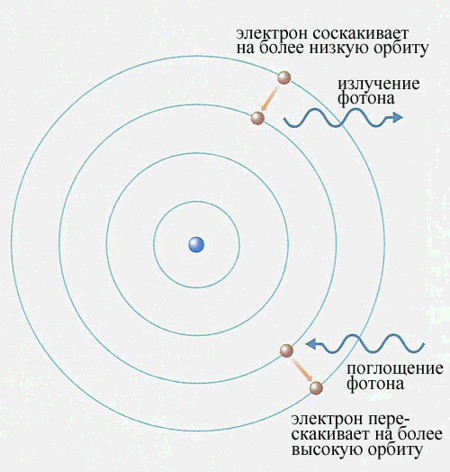
Ион – одно или многоатомная частица, несущая электрический заряд. Положительно заряженные ионы называются катионами, отрицательно заряженные – анионами. Ионизация – процесс превращения атомов в ионы при потере одного или нескольких электронов. Энергия ионизации ЕI – энергия, необходимая для удаления электрона от ядра. ЕI = Е∞-En = -2,18·10-18 Дж · [(1/∞)2-(1/n)2] =2,18·10-18 / n2 (Дж)
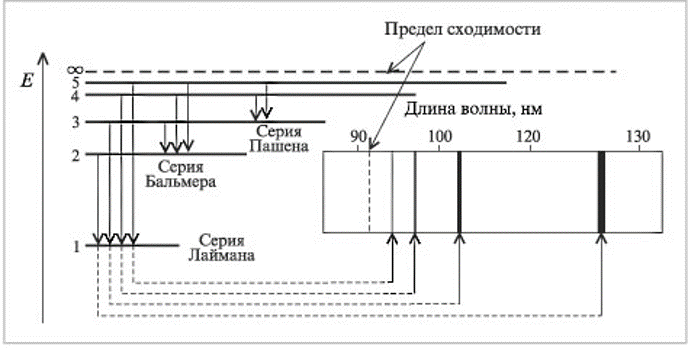
Пример. Вычислить длину волны света, поглощаемого атомом водорода при переходе из основного состояния на уровень с главным квантовым числом n = 2. = с/ν = hc / Eфот = hc / (E2-E1) = 6,63·10-34 Дж с · 3 ·108 м/с -2,18·10-18Дж [(1/4)-1] = =1,22 · 10-7 м. В спектре атоме водорода в серии Бальмера, отвечающей переходам на орбиту с главным квантовым числом n = 2, есть линия с длиной волны = 6,562·10-7 м. Определить, какому переходу она соответствует. При каком значении главного квантового числа радиус орбиты электрона в атоме водорода превысит 5 мкм? Вычислить энергию ионизации атома водорода, находящегося в первом возбужденном состоянии (n=2).

КОРПУСКУЛЯРНО-ВОЛНОВОЙ ДУАЛИЗМ
Электрон является одновременно и частицей, и волной. E = hν = mc2 = pc = h / р = h / (mv) где р – импульс электрона, v – скорость движения.
ЛУИ ДЕ БРОЙЛЬ (1892–1987)
Наличие у электрона волновых свойств было подтверждено экспериментально наблюдением дифракции на кристалле.
Пример. Вычислить длину волны де Бройля для пули массой 25 г, движущейся со скоростью 1000 м/с. = h / (mv) = 6,63·10-34 Дж·с/(0,025 кг·1000 м/с) = 2,65·10-35м. С какой скоростью должен передвигаться шарик массой 1 г, чтобы у него проявились волновые свойства, аналогичные γ-излучению? (λ=10-14 м)

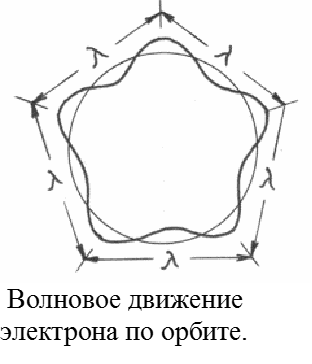
Движение электрона в атоме Н n = 2rB v = h / m = nh / (2rBm) Пример. Вычислить скорость движения электрона в атоме водорода в основном состоянии. v1 = 6,63·10-34 Дж·с / (2·3,14·9,1·10-31 кг ·0,53·10-10 м) = 2,19·106 м/с.
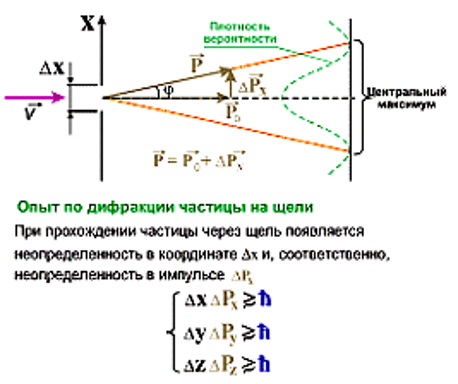
ПРИНЦИП НЕОПРЕДЕЛЕННОСТИ
Невозможно одновременно сколь угодно точно определить такие пары величин, как положение электрона в атоме, и его импульс.

ВЕРНЕР КАРЛ ГЕЙЗЕНБЕРГ (1901–1976)
Применение принципа неопределенности. Атом водорода в основном состоянии. Для электрона неопределенность в координате определяется соотношением Δx ≥ h/(2π·me·Δvx). При этом Δvx ≤ vx . Δx ≥ 6,63·10-34Дж·с / (2·3,14·9,11·10-31 кг·2,19·106 м/с). Δx ≥ 5,29·10-11 м. Неопределенность в координате электрона сопоставима с размером атома. Какова погрешность в определении координаты Δx для пули массой 25 г, движущейся со скоростью 1000 м/с, если погрешность в определении скорости составляет 0,1%?

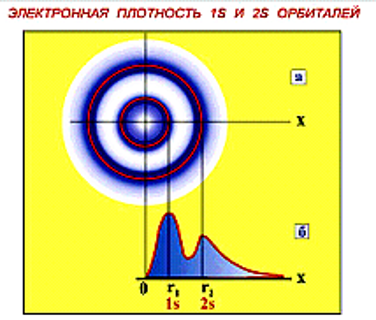
Атомная орбиталь
Область пространства, в которой вероятность обнаружить электрон превышает 90 %. Представляет собой разрешенное энергетическое состояние электрона в атоме. Отображается графически в виде контурной диаграммы. Вероятность нахождения электрона в определенной точке пространства рассчитывается из решения волнового уравнения Шредингера.
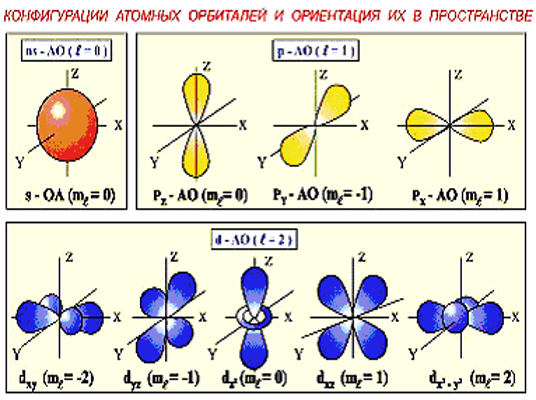
КВАНТОВЫЕ ЧИСЛА
Главное квантовое число n. Принимает значения 1, 2, 3 и т.д. Орбитальное квантовое число l. Может изменяться в пределах 0 l n-1. Магнитное квантовое число ml. Изменяется в пределах –l ml +l. Спиновое квантовое число ms. Может принимать значения + ½ или - ½.
ОХ. мод.2.3.
http://winter.group.shef.ac.uk/orbitron/
Принципы заполнения атомных орбиталей электронами.
Принцип минимума энергии: наиболее устойчивым состоянием атома является состояние с наименьшей энергией. Принцип запрета Паули: электроны в атоме должны отличаться друг от друга хотя бы одним квантовым числом. Правило Хунда: спин электронов, заполняющих орбитали с одинаковым значением орбитального квантового числа l, должен быть максимальным.
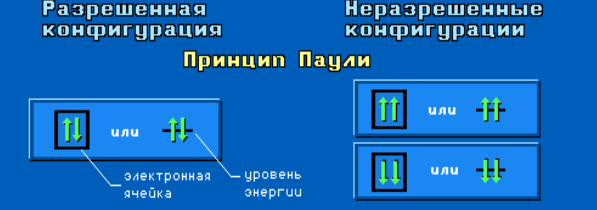
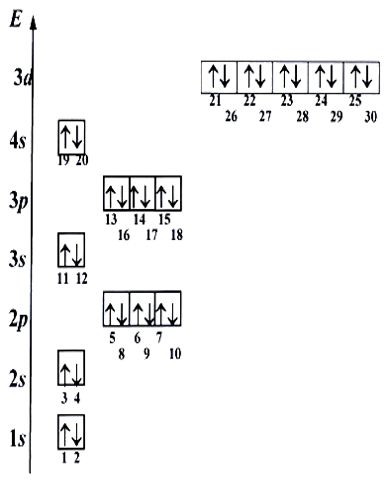
ПРАВИЛА В.М. КЛЕЧКОВСКОГО Во многоэлектронном атоме атомные орбитали заполняются электронами в порядке увеличения суммы квантовых чисел n+l, а при одинаковом значении этой суммы, первой заполняется орбиталь с минимальным значением n. Последовательность возрастания энергии электронных подуровней: 1s < 2s < 2 p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d...
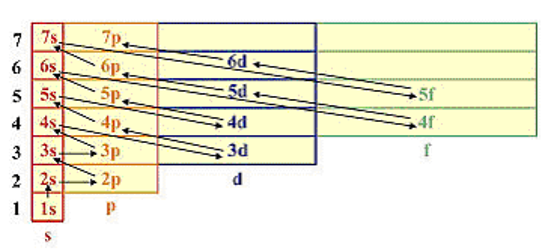
Максимально возможное число электронов на данном уровне Nmax = 2n2
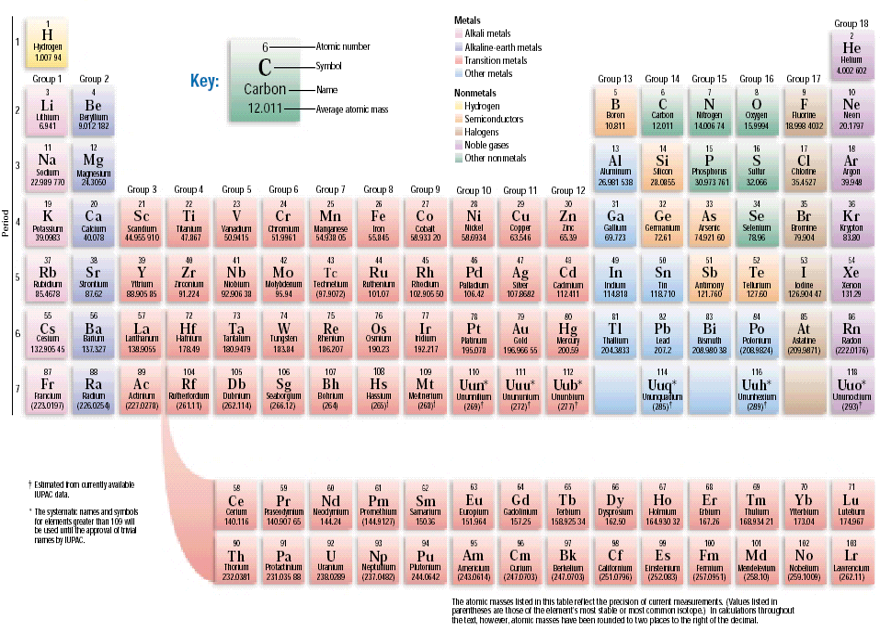
ЭЛЕКТРОННЫЕ КОНФИГУРАЦИИ АТОМОВ
Описывают распределение электронов по атомным орбиталям. При записи электронной конфигурации указывают главное квантовое число, затем тип орбитали (s, p, d и т. д.) и с помощью верхнего индекса количество электронов на данной орбитали. Н (1е) 1s1, Не (2е) 1s2, Li (3e) 1s22s1 [He]2s1, С (6е) 1s22s22р2 P (15e) 1s22s22p63s23p3
Задачи по теме
Напишите электронные конфигурации элементов N, O, Al, Si, Cl в основном состоянии. Пользуясь таблицей Менделеева указать, какие элементы имеют следующие конфигурации: [He]2s2, [Ne]3s23p5, [Kr]4d105s25p1. Относительная атомная масса некоторого элемента равна 75, а его электронная оболочка содержит 33 электрона. Определить, какой это элемент, указать состав ядра, написать его полную электронную конфигурацию. Сколько валентных электронов содержат атомы элементов с порядковыми номерами 17, 20, 33, 50?
ОБРАЗОВАНИЕ ИОНОВ
Первое сродство к электрону - изменение энергии, происходящее при присоединении первого электрона к газообразному атому или иону. Э + е- Э-.
Первая энергия ионизации - энергия, необходимая для удаления первого электрона из газообразного атома или иона. Э (г.) Э+ + е-.
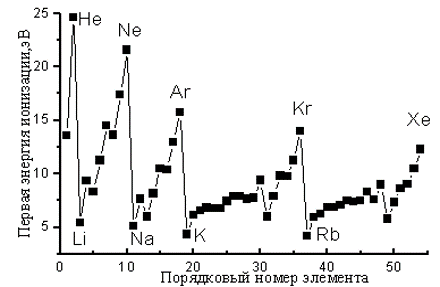
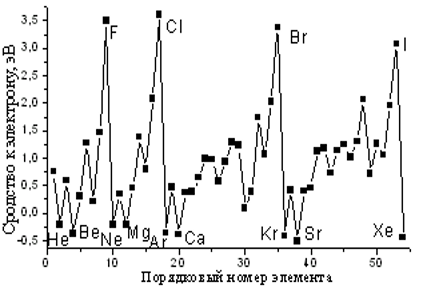
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ условная величина, характеризующая способность атома в химическом соединении удерживать электроны.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.