
Общая Химия
Курс для специальностей 060801, 060807, 071800. Рассчитан на 1 семестр (150 ч., из них 17 ч. - лекции, 17 ч. - семинары). Итоговая оценка – зачет.


Список литературы
Интернет-сайты по химии

– в разделе учебной литературы представлен учебник Коренева-Овчаренко по общей и неорганической химии (pdf). – виртуальный учебник Мануйлова “Основы химии”. – материалы диска “Открытая химия 2.5”: курс, задачи, биографии, история и т.д. – в разделе “Электронная библиотека” представлены отсканированные учебники по химии (djvu).
Требования к реферату

В реферате по выбранной теме обязательно должны быть: • Титульный лист (с указанием учебной дисциплины, темы реферата, ФИО автора, номера группы.) • Введение (1-2 стр.) • Основная часть, поделенная на смысловые подразделы. Объем - мин. 10 стр., макс. 25 стр., напечатанные через 1 или 1,5 интервала. • Заключение (1-2 стр.) • Список использованной литературы (не менее 3 источников).
Химия

наука, изучающая вещества и их превращения, сопровождающиеся изменением их состава и (или) строения. В течение курса будут рассмотрены темы: предмет изучения химии; строение и свойства веществ; общие закономерности протекания химических процессов; физико-химические методы исследования веществ.
НАУКА – сфера человеческой деятельности, функция которой – выработка и теоретическая систематизация объективных знаний о действительности.
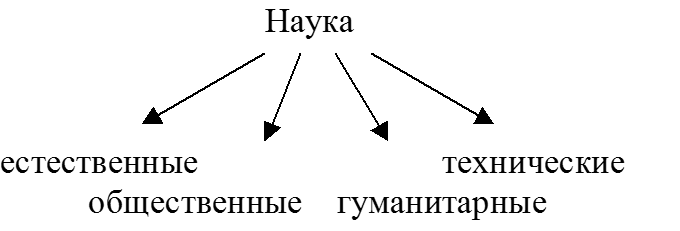
К естественным наукам в первую очередь относятся: химия, физика, биология, геология, астрономия, математика. Предмет изучения естественных наук – законы развития материального мира. Основное отличие естественных наук от гуманитарных и общественных дисциплин – стремление дать объективную картину окружающего мира.
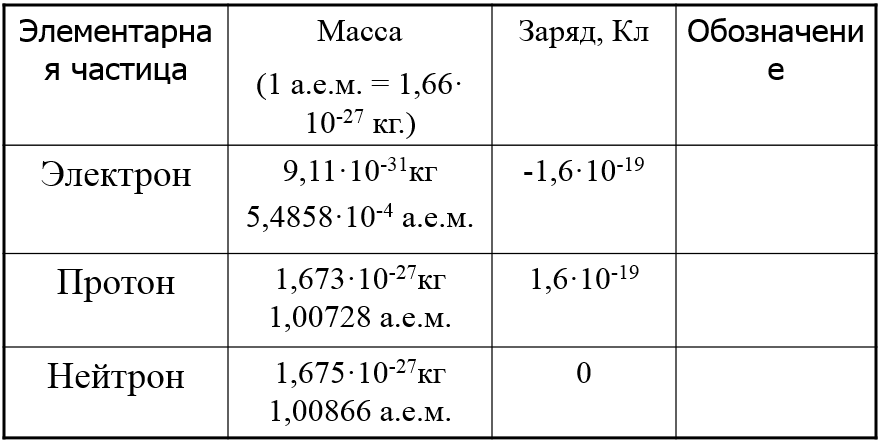
ВЕЩЕСТВО – вид материи, которая обладает массой покоя и состоит из элементарных частиц – электронов, протонов, нейтронов.
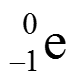
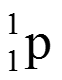
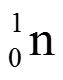
Атом
(Г.-Ю. гл. 2-4, Гл. гл. 1-3)
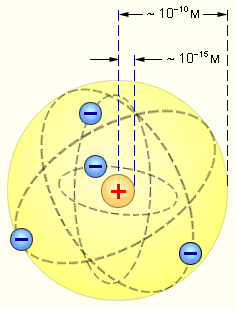
мельчайшая частица вещества, которую химическим путем невозможно разделить на составные части, превратить друг в друга или уничтожить. Размер атомов не превышает 5·10-10 м, (ОХ. мод. 1.1.) массы атомов не превышают 4·10-25 кг.


Поверхность кристалла вольфрама, увеличенная с помощью ионного микро-скопа в 10 миллионов раз.
Химический элемент
Совокупность атомов одного вида.

Самый лёгкий из металлов – Li (ρ=0,5334 г/см3), самый тяжелый – Os (ρ= 22,59 г/см3). Самый легкоплавкий металл – Hg (–38,836°С), самый тугоплавкий W (3420°С).
Распространенность химических элементов на Земле.
СТРОЕНИЕ АТОМА. ПРОТОННО-НЕЙТРОННАЯ ТЕОРИЯ.
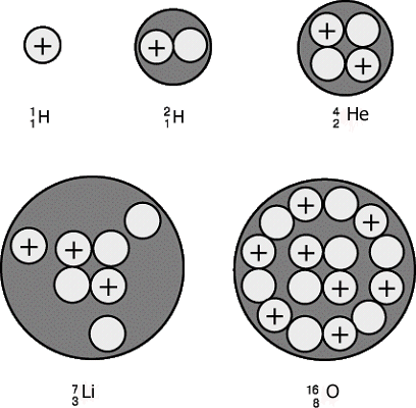
В центре атома существует положительно заряженное ядро, которое имеет очень маленькие размеры по сравнению с размерами атома (диаметры атомных ядер не превышают 10–15 - 10–14 м. ) Атомное ядро состоит из протонов и нейтронов. В нем сосредоточена основная масса атома. Массовое число – общее количество протонов и нейтронов в ядре атома. A = Np + Nn. Каждый химический элемент характеризуется определенным зарядом ядра, т.е. числом протонов Np. Оставшуюся часть пространства атома занимают отрицательно заряженные электроны. Их количество равно числу протонов. Ne = Np.
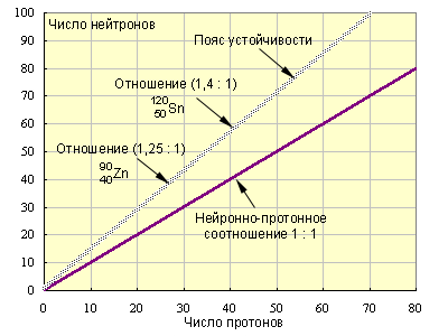
(ОХ. мод. 11.1.)
Изотопы - атомы одного химического элемента, различающиеся по количеству нейтронов Nn в ядре. Изотопы отличаются по физическим свойствам, но в химических реакциях ведут себя практически одинаково.
Относительная атомная масса Ar – безразмерная величина, показывающая, во сколько раз масса данного атома mi больше 1/12 массы атома 12С. Ar = mi / (m(C)/12). Относительная атомная масса элемента Ar(Э) – средневзве-шенное относительных изотопных масс элемента (учитывает содержание данного изотопа в природе i). Ar(Э) = i·Ari. Пример. Найти относительную атомную массу хлора, если известно, что существуют два изотопа хлора 35Cl и 37Cl с относительной изотопной массой 34,97 и 36,95 и относитель-ным содержанием 75,53% и 24,47% соответственно. Ar (Сl) = (34,97 · 0,7553) + (36,95 · 0,2447) = 35,45. Значение относительной атомной массы меди равно 63,55. Медь содержит два изотопа с массовыми числами 63 и 65. Определить процентное содержание изотопов.
Молярная масса M – масса 1 моль вещества. Измеряется в г/моль. Для элементов M(Э) = Ar (Э) (г/моль) 1 моль любого элемента содержит такое же количество атомов, которое содержится в 12 г изотопа 12С. Это число называется постоянной Авогадро NA= 6 · 1023 моль-1. Количество молей вещества n в образце определяется n = m / M = N / NA. Масса одного атома определяется mат = M / NA. Пример. Пылинка алюминия имеет массу 10-8 г. Определить, из какого числа атомов она состоит. N = NA m/M = 6 · 1023 моль-1 10-8г / 27 г/моль = 2,2 · 1014 атомов. Из какого числа атомов состоит 1 г магния?
Периодический закон и система элементов
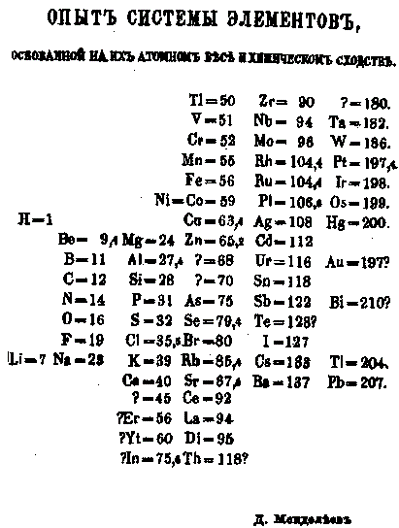

ДМИТРИЙ ИВАНОВИЧ МЕНДЕЛЕЕВ (1834–1907)
Периодический закон: “Свойства элементов, а также образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра”.
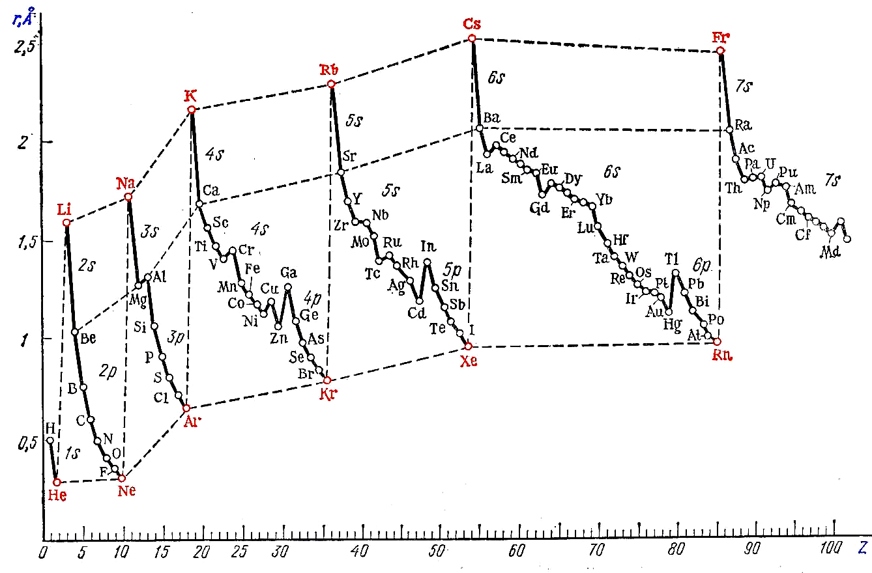
Зависимость атомного радиуса элемента от его порядкового номера.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.