- физ.адс. как правило не облад. Специфичностью;
хим.адс.вследствие своей природы оч.спец-на.
- физ.адс.всегда обратима; хим.адс,как правило не обратима
- физ.адс,может привести к обр-ю полимолекулярного слоя; хемосорбция прак-ки всегда протек.с об-роем мономолекулярного слоя адсорбированных молекул.
- физ.адс.всегда экзотермична (с выделением тепла); хемосорбция м.б. и эндотермичной.
- под действ. яда хемосорбция может полностью подавляться в то время как физ.адс. не делает разницы м/у адсорбируемыми в-вами.
Для гетерогенного кат-за физ.адс не играет реш.роли.Однако надо иметь ввиду, что любая хемосорбция начинается с физ.адс. и все гетерогенные кат-кие процессы, пройдя стадии физ. и хим. адс., всегда заканчиваются хемосорции.
10.Энергетика и хим.природа катализа.
В соответствии с современными представлениями о сущности кат-за катализатор и реагирующ.в-ва следует рассматривать как единую кат-кую реакционную систему, в кот.хим.превращения испытывают не только реагирующие в-ва, но и кат-р.
В рез-те такого взаимного воздействия в реакцион.системе устан-ся стационарный состав пов-ти кат-ра, опред-щий его кат-кую активность.
Принципы осуществления кат-ких процессов:
1.кат-р должен взаимодейст-ть хотя бы с одним из компонентов реагир.в-в с образованием хим.связей
2.изменение свобод.энергии процессов взаимод-я в кат-кой реакционной системе д.б.менее отрицательно, чем изменение свобод.энергии катализируемой р-ии. Это означает, что соединение реагирующих в-в с кат-ром д.б.менее т/д-ки прочным, чем прод-ты р-ии.
3.Многостадийный кат-кий процесс будет т/д-ки более выгодным, если изменение свобод.энергии будет на каждой из стадий процесса примерно одинаковы и равныполовине изменения теплового эффекта суммарного процесса.
4.Кат-кая р-я будет идти с большей скоростью, если в рез-те промежуточного хим.взаимод-я кат-р будет снижать энергию активации хим.р-ии.
5.Установлена опред-ная закономерность м/у специфичностью каталитического действия и типом кристаллич.стр-ры твёрд.тел. Кат-кой активностью ионного ионного и электронного типа обладают тв.тела с ионной и металл-кой кристаллической структурой, а также кристаллы промежуточного ионно-металического типа.
Молекулярные и ковалентные кристаллы в отношении кат-за практически инертны.
![]() Первичной основой(структурной единицей
кристаллич.решётки циалитов Х и У явл. тетраэдр, состоящий из 4-х анионов О2,
кот.окружены значит-но меньшими по размерам ионами кремния или Al.
Тетраэдры из оксидов кремния или аллюм расположены так, что циалиты
имеютоткрытые участки структуры.Это и создаёт сист.пор с высокой удельной
поверхностью. Хим.формулу первичной стр-ры циалитов можно изобразить
след.образом:
Первичной основой(структурной единицей
кристаллич.решётки циалитов Х и У явл. тетраэдр, состоящий из 4-х анионов О2,
кот.окружены значит-но меньшими по размерам ионами кремния или Al.
Тетраэдры из оксидов кремния или аллюм расположены так, что циалиты
имеютоткрытые участки структуры.Это и создаёт сист.пор с высокой удельной
поверхностью. Хим.формулу первичной стр-ры циалитов можно изобразить
след.образом:
Тетраэдры с ионами электрически нейтральны, а тетраэдры с ионами имеют заряд -1, кот.компенсируется «+» зарядомкатиона металла. Наличие заряженных ионов Al на пов-ти циалита (центры Бренстона) и обуславливают кислот.св-ва,а след-но и кат-кую активность циалитов.
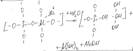 Натриевая форма циалитов кат-ки малоактивна и
наименее термостабильна. Оба эти показателя сущ-но улучшаются при повышении
силикатного модуля циалитов, а также степени ионного обмена катиона Na на
2-х валентные, а особенно 3-х валентные металлы. Среди этого типа циалитов наиб.активны
и термостабильны рениевые циалиты. В условиях воздействия высоких Т и
водяного пара циалиты этого типа подвергаются частичной деалюминации:
Натриевая форма циалитов кат-ки малоактивна и
наименее термостабильна. Оба эти показателя сущ-но улучшаются при повышении
силикатного модуля циалитов, а также степени ионного обмена катиона Na на
2-х валентные, а особенно 3-х валентные металлы. Среди этого типа циалитов наиб.активны
и термостабильны рениевые циалиты. В условиях воздействия высоких Т и
водяного пара циалиты этого типа подвергаются частичной деалюминации:
В рез-те этого процесса в кристаллич.стр-ре циалитаобр-ся пустота, что явл.причиной постепенного разрушения кристалла циалита. Эти недостатки циалитов привели к разработке нового поколения циал.,не сод-щих редкоземельных элементов (хим-ки стабилизированных ц-тов). Химич. Стабилизация заключ-ся в низкотемпературной химической обработке фторсиликатом аммония.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.