














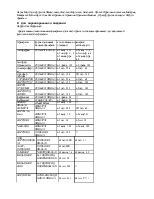







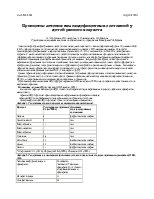
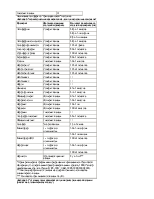
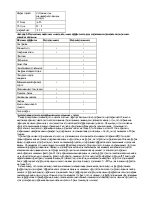









Ежесуточный прирост НЬ у детей этой подгруппы был минимальным и составил в среднем 1,6±0,16 г/ л/сут с индивидуальными колебаниями от 0,8 г/л/ сут до 2,5 г/л/сут. По окончанию курса лечения парентеральными препаратами Fe в среднем уровень НЬ увеличился до 98,5 г/л.
Использование Р и АЦЦ оказалось более эффективным. Так, у детей, получавших Р (табл. 3), происходило достоверное снижение в сыворотке крови концентрации молочной кислоты (р<0,01). Содержание конечного продукта липопероксидации — ЛФПП — также достоверно понижалось (р<0,05). Значительные изменения претерпевали ферменты системы САПЗ. Так, активность СОД и каталазы достоверно возрастала (р<0,001), а концентрация глутатиона достоверно уменьшилась на 36% (р<0,01). Таким образом, в условиях нормализации функции основных ферментов САПЗ нет необходимости в больших количествах глутатиона.
Что же касается содержания конечного продукта распада пуринов — мочевой кислоты, то ее концентрация имела тенденцию к уменьшению, будучи выше по сравнению с уровнем таковой у здоровых детей (138 ± 8,2 мкмоль/мл и 90,7 ± 3,9 мкмоль/мл соответственно), что может объясняться как расщеплением самой молекулы рибоксина, так и активацией ксантиндегидрогеназы, вызывающей распад пуринов до урата, но без образования активных форм кислорода. Ежесуточный прирост НЬ в этой подгруппе был максимальным и составил в среднем 2,2±0,18 г/л/ сут. К окончанию курса лечения парентеральными препаратами Fe и Рибоксина средний уровень НЬ достиг 107,7 г/л. Выявлена прямая корреляционная связь между уровнем суточного прироста НЬ и активностью СОД (г = 0,33; р<0,05).
В подгруппе детей, получавших на фоне ферротерапии АЦЦ (табл. 4), отмечалось достоверное уменьшение концентрации мочевой кислоты (р<0,05), которая практически достигала значения таковой у здоровых детей, и падение уровня ЛФПП (р<0,001).
Система антирадикальной защиты реагировала на назначение препарата достоверным повышением активности каталазы (р<0,001) и уровня глутатиона (от 0,678±0,08 мкмоль/мл до 0,94±0,09 мкмоль/ мл), что патогенетически обосновано структурой его молекулы. Активность СОД повышалась незначительно и недостоверно, что подтверждает идею о функциональном взаимодействии компонентов систем антирадикальной и антиперекисной защиты [2].
Ежесуточный прирост НЬ в данной подгруппе составил в среднем 2,1 ± 0,22 г/л/сут. В среднем у пациентов, получавших АЦЦ, уровень НЬ к окончанию курса парентеральной терапии препаратами Fe составил 100,6 г/л. Выявлена прямая корреляционная связь между суточным приростом НЬ и концентрацией глутатиона (г = 0,38; р<0,01).
1. Причинами ЖДА у наблюдаемых нами больных послужили недостаточное поступление железа от беременной плоду в силу гипосидероза женщины, гестозов 2-й половины беременности, угрозы прерывания беременности, недоношенности, многоплодия и неадекватное вскармливание детей после рождения.
2. У 14,6% больных ЖДА был выраженный гемолиз эритроцитов, что документировалось ретикулоцитозом (более 30%о) и сопровождалось выраженной эритроцитопенией (менее 2,0 • 1012/л).
3. Расстройство метаболизма в эритроцитах больных ЖДА сопровождалось усилением деградации пуриновых нуклеотидов и увеличением в крови уровня конечного продукта их распада — мочевой кислоты. Гиперурикемия более 130 мкмоль/мл свидетельствует о тяжести метаболических расстройств.
4. Повышенный катаболизм пуринов при ЖДА — дополнительный механизм инициации процессов ПОЛ клеточных мембран и дисбаланса в антиоксидантной системе, выражающийся в торможении в эритроцитах активности каталазы на фоне увеличения содержания глутатиона.
5. Максимальный уровень метаболических отклонений (по содержанию в сыворотке крови мочевой кислоты, активности начальных, конечных продуктов липопероксидации и ферментов антиперекисной защиты в эритроцитах) регистрировался у детей с документированным гемолизом.
6. Использование в лечении наряду с препаратами железа Рибоксина или АЦЦ предотвращает чрезмерную липопероксидацию мембранных структур, повышает эффективность системы антиперекисной и антирадикальной защиты, сопровождаясь интенсификацией суточного прироста гемоглобина.
ЛИТЕРАТУРА
1.Гематология детского возраста. Руководство для врачей / Под ред. Н. А. Алексеева. — СПб., 1998. — 544 с.
2. Головин А. А. Метаболические и иммунные механизмы в патогенезе железодефицитной анемии и ее осложнений: Дисс. ... докт. мед. наук. — Омск, 1992. — 340 с.
3.Казакова Л. М. // Педиатрия. — 1997. — №2.— С. 88—89.
4. Конвой В. Д. Нарушение пуринового обмена в печени в постреанимационном периоде и его профилактика:
Дисс. ... докт. мед. наук. — Омск, 1988. — 426 с.
5. Конвай В. Д., Лукошкин А. В. Способ определения активности каталазы // Изобретательство и рационализация в медицине. Обл. науч.-практич. конф. — Омск, 1988. — С. 31—34.
6. Чумакова В. Н., Осинская Л. Ф. // Вопр. мед. химии. — 1977. — Т. 23, № 5. — С. 712—716.
7. Bragdon J. Н. // 3. biol. chem. — 1951. —Vol. 190, № 2. — P. 513—517.
8. Fletcher В. L., Dillard С. J. Tappel Н. L. // Anal. Biochem. — 1973. — Vol. 52, № 1. — P. 1—9.
9. Folch J. Lees М. Stonesstaenly J. М. // J. Biol. Chem. — 1957. — Vol. 226, № 2. — P. 497—509.
10. Hohorst Н. J. Metoden des enzymatischen Analyse // Berlin: Academie — Verlag
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.