Санкт-Петербургский Государственный Университет Информационных Технологий, Механики и Оптики
кафедра
физики и техники оптической связи
ЛАБОРАТОРНАЯ РАБОТА №5
ОПРЕДЕЛЕНИЕ ЭЛЕКТРОДНЫХ ПОТЕНЦИАЛОВ МЕТАЛЛОВ
Студент
Группа 1222
Преподаватель
Коллоквиум ______________
Цель работы
Определить электродные потенциалы Cu, Pb, Zn, Fe, Ni. Изучить изменение величины электродного потенциала цинка в зависимости о концентрации раствора соли цинка.
Теоретическая часть
Любой металл обладает растворимостью в электролите, пусть даже ничтожной. Если металлическую пластинку погрузить, к примеру, в воду, то ионы металла в результате действия на них полярных молекул воды могут отрываться от поверхности и переходить в прилегающий к ней слой воды; так что нейтральный до того атом превращается в положительно заряженный ион:
Ме o® Ме n+ + n ē
Процесс носит динамический характер, так что в электролите у поверхности металла создается определенное перераспределение концентраций ионов растворителя и металла и молекул растворителя.
Итак, взаимодействие металла с водой или раствором, содержащим ионы этого металла, приводит к образованию у поверхности двойного электрического слоя и появлению разности потенциалов между металлом и раствором. Эта разность потенциалов включает в себя падение потенциала в слое адсорбированных на поверхности ионов (jа) и падение потенциала в растворе (в диффузионном слое (jд):
j = jа + jд
Переход ионов из металла в раствор – процесс обратимый и изотермический, здесь система совершает максимальную полезную работу А, характеризуемую изобарно-изотермическим потенциалом Гиббса DG°р:
Aэл = -DG = -n×F×j
где n - заряд иона; j - разность потенциалов между металлом и раствором, F - число Фарадея.
Равновесие имеет динамический характер: часть ионов приповерхностного слоя диффундирует в электролит, другие ионы из раствора замещают их. В результате равновесная концентрация ионов металла у поверхности электрода С0 оказывается иной, чем средняя концентрация ионов в растворе С.
Изотермическая работа по перемещению 1 моля ионов между приповерхностным слоем и объемом раствора определяется как:
А = R×T×ln(С0/С)
Из условия равенства этих работ следует:
DG° = -n×F×j = R×T×ln(С0/С)
Отсюда может быть найден потенциал электрода:
R×T
j = ______ ×ln (С/С0)
n×F
Концентрацию С0 определить экспериментально невозможно, поэтому потенциал изолированного электрода, погруженного в раствор электролита, рассчитать не представляется возможным. Однако можно определить разность потенциалов (ЭДС = DЕ = j2 – j1) между одинаковыми электродами, погруженными в раствор собственного иона, но с различной концентрацией, так называемый концентрационный элемент:
R×T R×T
j2 – j1 = _____ [ln(С2/С0) – ln(С1/С0)] = ______ ln(С2/С1)
n×Fn×F
или для стандартных условий (298 К) и после замены натурального логарифма на десятичный:
j2 – j1 = (0,059/n) ×lg(С2/С1)
В электрохимии принято измерять электродные потенциалы металлов в вольтах, обозначаемые Е, по отношению к некоторому стандартному электроду сравнения, потенциал которого условно принят за нуль. По международному соглашению в качестве такого электрода сравнения применяется стандартный водородный электрод , а условной величиной, характеризующей потенциал рассматриваемого электрода, принимают ЭДС гальванического элемента, составленного из этого электрода и стандартного водородного электрода. Эту величину называют электродным потенциаломданного электрода и обозначают буквой Ео. Таким образом, принимая концентрацию ионов металла в адсорбционном слое С0 = 1моль/л, получаем ЭДС элемента, составленного из металлов одного вида, но с разной концентрацией ионов в растворе:
R×T
DЕ = Е-Ео = ¾¾× ln(CMen+)
n×F
или:
R×T
Е = Ео + ¾¾× ln(CMen+)
n×F
где CMen+ – молярная концентрация ионов.
Это уравнение называется уравнением Нернста.
Уравнение является приближенным, поскольку не учитывает межионного взаимодействия в растворах электролитов. Для учета этого взаимодействия вводится активность иона, связанная с его концентрацией следующим соотношением:
a = f×C
где f - коэффициент активности.
Уравнение для расчета электродных потенциалов также имеет вид:
Е = Ео + (0,059/n) × lg(an-)
Порядок выполнения работы
Работа проводится в два этапа: на первом этапе измеряются стандартные электродные потенциалы металлов при их погружении в растворы соответствующих солей с концентрациями 1 моль/л; на втором этапе исследуется зависимость электродных потенциалов одного металла (цинка) при погружении его в растворы соли цинка с различными концентрациями: 0,1М; 0,5М; 1,0М и 1,5М.
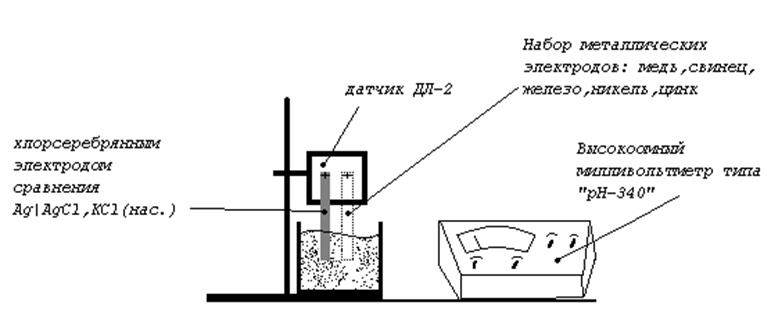
1. Получить набор электродов.
2. Перед измерениями каждый раз зачищать наждачной бумагой поверхность электрода.
3. Последовательно подсоединять исследуемые электроды к датчику, составляя гальваническую цепь из измеряемого электрода и хлорсеребряного электрода сравнения. Оба электрода при этом должны быть погружены в раствор соответствующей соли необходимой концентрации.
4. На приборе определить ЭДС.
5. Подсчитать величину измеренной ЭДС (DЕ) в мВ. Для этого полученное показание прибора умножить на 100.
6. После каждого измерения хлорсеребряный электрод должен быть погружен в дистиллированную воду.
Измерения
Zn(0,1) 795 мB = 0,795 В Zn(NO3)2
Zn(0,5) 807 мB = 0,807 В Zn(NO3)2
Zn(1,0) 830 мB = 0,830 В Zn(NO3)2
Zn(1,5) 856 мB = 0,856 В Zn(NO3)2
Ni(1,0) 50 мВ = 0,050 В Ni(NO3)2
Pb(1,0) 380 мВ = 0,380 В Pb(NO3)2
Fe(1,0) 463 мВ = 0,463 В FeCl3
Cu(1,0) 115 мВ = 0,115 В Cu(NO3)2
Расчеты
ECu/Cu2+ = DЕ + Eхс
ЕZn/Zn2+ = Exc –½DЕ½
ЕNi/Ni2+ = Exc –½DЕ½
ЕFe/Fe2+ = Exc –½DЕ½
ЕPb/Pb2+ = Exc –½DЕ½
Eхс = 0,202 В
DЕ – найдено нами.
ECu/Cu2+ = 0,115 + 0,202 = 0,317 В
ЕNi/Ni2+ = 0,202 – 0,050 = 0,152 В
ЕFe/Fe2+ = 0,202 – 0,463 = -0,261 В
ЕPb/Pb2+ = 0,202 – 0,380 = -0,178 В
[E]=[B+B]=B
DG = - n×F×DЕ
DG0pCu = -2*96484*0,115 = -22191,3 (дж/моль)
DG0pNi = -2*96484*0,050 = -9648,4 (дж/моль)
DG0pFe = -2*96484*0,463 = -89344,2 (дж/моль)
DG0pPb = -2*96484*0,380 = -73327,8 (дж/моль)
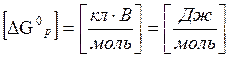
|
Исследуемый электрод |
Схема гальванического элемента |
ЭДС,В |
ЕMe/Men+ рассч.,В |
E0, В |
DG0p дж/моль |
|
Cu |
Cu|Cu2+||KCl,AgCl |
0,115 |
0,317 |
0,340 |
-22191,3 |
|
Ni |
Ni|Ni2+||KCl,AgCl |
0,050 |
0,152 |
-0,250 |
-9648,4 |
|
Fe |
Fe|Fe2+||KCl,AgCl |
0,463 |
-0,261 |
-0,440 |
-89344,2 |
|
Pb |
Pb|Pb2+||KCl,AgCl |
0,380 |
-0,178 |
-0,130 |
-73327,8 |
ЕZn/Zn2+
Экспериментальные:
(0,1 М) ЕZn/Zn2+ = 0,202 – 0,795 = -0,593 В
(0,5 М) ЕZn/Zn2+ = 0,202 – 0,807 = -0,605 В
(1,0 М) ЕZn/Zn2+ = 0,202 – 0,830 = -0,628 В
(1,5 М) ЕZn/Zn2+ = 0,202 – 0,856 = -0,654 В
Расчетные:
По формуле Нернста:
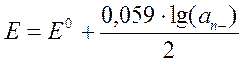
(0,1 М)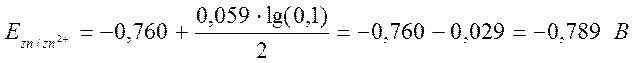
(0,5 М)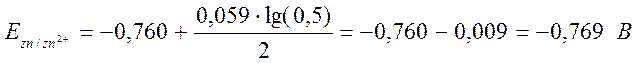
(1,0 М)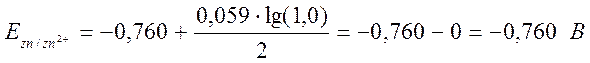
(1,5 М)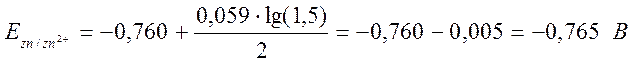
![]()
Погрешности:
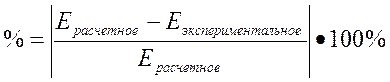
(0,1) 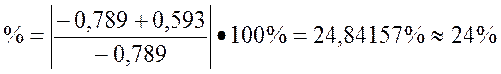
(0,5) 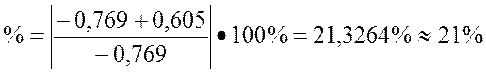
(1,0) 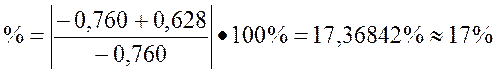
(1,5) 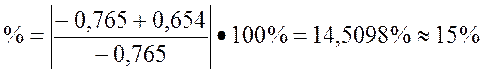
|
Исследуемый электрод |
Схема гальванического элемента |
Концентрация электролита |
ЭДС,В |
Электродный потенциал Е, В |
погреш- ность измере- ний |
|
|
экспер |
расчетн |
|||||
|
Zn |
Zn|Zn2+||KCl,AgCl|Ag |
0,1 |
0,795 |
-0,593 |
-0,789 |
24% |
|
0,5 |
0,807 |
-0,605 |
-0,769 |
21% |
||
|
1,0 |
0,830 |
-0,628 |
-0,760 |
17% |
||
|
1,5 |
0,856 |
-0,654 |
-0,765 |
15% |
||
Вывод
Проведя эксперимент и сделав необходимые расчеты, мы определили электродные потенциалы меди, свинца, железа и никеля, а также изучили изменение величины электродного потенциала цинка в зависимости от концентрации раствора соли цинка, при этом наша погрешность была от 15% до 24% вследствие некачественной зачистки электрода перед каждым измерением.
Также нашли несколько различий в теории и практике:
I
С увеличением концентрации электродный потенциал цинка увеличивался
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.