представляет собою количественную меру интенсивности поглощения света.
Если концентрация С выражена в [моль/л], а толщина слояl — в [см], то коэффициент e имеет размерность [л / моль · см].
Значение молярного коэффициента поглощения e для различных веществ колеблется в довольно широких пределах, от единиц (например, для хлоридов редкоземельных элементов) до сотен тысяч (для ряда органических красителей, металлокомплексных соединений и др.).
Чаще используется выражение закона Б-Л-Б через десятичный логарифм:
lg (1/ Т) = 2,3 e·С·l = e'·С·l.
Зависимость молярного коэффициента поглощения e' от природы поглощающего свет вещества очень сложна и может изменяться даже для одного и того же типа частиц в широких пределах. Так, молярный коэффициент поглощения e' некоторых окрашенных соединений титана зависит от применяемого растворителя, и имеет следующие значения:
Растворитель Перекись водорода Хромотроповая кислота Пропилтриоксифлюорон
e', л / моль · см 500 6000 520000
Логарифм отношения интенсивностей света, падающего на образец I0 и пропущенного образцом It, называется оптической плотностью вещества или образца: D = lg (I0/ It). Таким образом, закон Б-Л-Б может быть записан еще и так:
D = e'·С·l .
Из этого уравнения следует, что оптическая плотность D прямо пропорциональна концентрации С поглощающего свет вещества в системе, в частности, в растворе. Этот факт представляет большую практическую ценность, так как позволяет следить за изменением концентрации участников химической реакции, в случае, если они обладают характерной окраской (см. раздел 6.1 настоящего курса).
7.1.2. Принципы теории цветности.
Обнаружена несомненная связь между химическим составом, строением соединений и их цветом, описываемая теорией цветности. Среди принципов этой теории основными являются нижеследующие.
Поглощение света веществом, как правило, различно на различных длинах волн, чем и определяется спектр поглощения образца. На рис. 2 и 3 приведены соответствующие кривые для растворов хромата калия и сульфата меди.
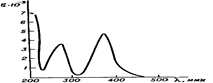
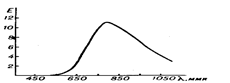
Рис. 2. Спектр поглощения раствора Рис. 3. Спектр поглощения раствора сульфата меди. хромата калия.
Органические молекулы тоже поглощают свет селективно: насыщенные углеводороды, например, прозрачны для излучения с λ > 150 нм, алифатические альдегиды и кетоны поглощают свет в диапазоне 230< λ <330 нм.
Из спектральной зависимости поглощения следует, что с длиной волны должно изменяться и относительное пропускание образца. В спектре пропускания образца воспринимаются зрением или регистрируются приборами только те участки спектра, которые не поглотились веществом. Так, если некий раствор видится красным или зеленым, то это значит, что он поглотил свет на всех прочих длинах волн, кроме тех, что соответствуют данному цвету.
Причиной избирательного поглощения квантов света веществом является дискретный характер значений энергий, которыми электрон может обладать, находясь на атомных или молекулярных орбиталях. Электрон может поглотить квант света только той энергии, которая соответствует разности между энергиями возможных состояний электрона (орбиталей) в атоме или в молекуле.
Ощущение цвета возникает в результате воздействия на зрительный нерв электромагнитных излучений с частотами в пределах n = 4·1014 – 7,5·1014 с – 1, то есть с длинами волн l ≈ 350 — 760 нм. При этом совместное действие на зрительный нерв электромагнитного излучения во всем указанном интервале (называемом видимой частью спектра) вызывает ощущение белого света. Раздельное же действие излучения с определенной длиной волны или совокупностью длин волн, оставшихся после поглощения света веществом, воспринимается глазом, как окраска образца. В табл. 2 приведены спектральные цвета с их длинами воли и дополнительные цвета, ощущение которых возникает, если из белого цвета изъять какой-нибудь из спектральных цветов.
Непрозрачное тело кажется белым, когда оно в одинаковой степени отражает свет на протяжении всей видимой части спектра, черным — когда оно полностью поглощает, серым — когда приблизительно одинаково, но не полностью, поглощает излучение видимого диапазона и цветным — когда избирательно поглощает некоторые из них.
Из уравнения Планка следует, что излучениям видимой части спектра соответствуют фотоны с энергиями 1,5 - 4,0 эВ, и для того чтобы тело оказалось окрашенным, энергия возбуждения его молекул: DЕ = Е* – Е0, где Е0 и Е* — энергия молекулы в основном и в возбужденном состояниях. Указанным значениям энергии возбуждения отвечают переходы между различными энергетическими уровнями электронов в молекуле.
|
Длины волн, нм |
Спектральный цвет |
Дополнительный цвет |
|
400—435 |
Фиолетовый |
Зеленовато-желтый |
|
435—480 |
Синий |
Желтый |
|
480—490 |
Зеленовато-синий |
Оранжевый |
|
490—500 |
Синевато-зеленый |
Красный |
|
500 - 560 |
Зеленый |
Пурпурный |
|
560 - 580 |
Желтовато-зеленый |
Фиолетовый |
|
580—595 |
Желтый |
Синий |
|
595—605 |
Оранжевый |
Зеленовато-синий |
|
605—730 |
Красный |
Зеленовато-синий |
|
730—760 |
Пурпурный |
Зеленый |
Если кривая поглощения построена в координатах: коэффициент молярного поглощения, e — длина волны l (рис.4), то положение ее максимума на оси абсцисс (lмакс) определяет цвет образца и является мерой энергии электронного перехода (энергии возбуждения). Коэффициент молярного поглощения eмакс по оси ординат характеризует интенсивность окраски и является мерой вероятности электронного перехода, т. е. вероятности того, что при взаимодействии со светом длины волны
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.