



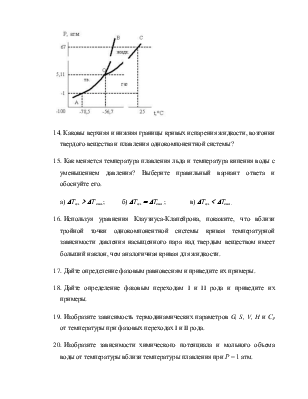



















диаграммы состояния воды видно,
что изобара при Р = 1 атм пересекает кривую плавления в точке,
отвечающей температуре плавления льда, при которой существуют фазовое равновесие
Н2О(лед) Û Н2О(ж)
и Dm = 0, т.е. m(лед) = m(ж). Для
индивидуального вещества химический потенциал представляет собой молярное
значение энергии Гиббса 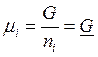 ,
а
,
а 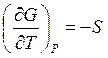 , и
зависимость химического потенциала от температуры для твердой и жидкой фаз
выражается соответствующими уравнениями:
, и
зависимость химического потенциала от температуры для твердой и жидкой фаз
выражается соответствующими уравнениями:
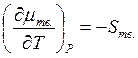 и
и 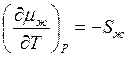 . Поскольку
величина энтропии всегда положительна, то химические потенциалы жидкой воды и
льда вблизи температуры плавления убывают линейно, а наклоны прямых
определяются величиной энтропии: Sлед<Sж , поэтому
. Поскольку
величина энтропии всегда положительна, то химические потенциалы жидкой воды и
льда вблизи температуры плавления убывают линейно, а наклоны прямых
определяются величиной энтропии: Sлед<Sж , поэтому 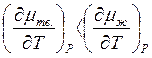 ,
т.е. mж = f(T) идет круче.
,
т.е. mж = f(T) идет круче.
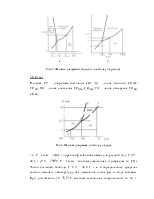
Объем твердой и жидкой фаз с повышением температуры увеличивается, а при Т = Тпл. объем меняется скачком, причем Vльда>Vж для воды (DV¹ 0).
21. Ответ
При температуре кипения между жидкой водой и паром устанавливается гетерогенное равновесие, относящееся к фазовым переходам I рода:
Н2О(ж) Û Н2О(пар), условием которого
является равенство химических потенциалов: m(ж)= m(пар) или
Dmисп.= 0. При повышении температуры m(ж) и m(пар) уменьшается, т.к. 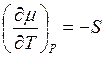 , а S
всегда положительна. Чем больше S, тем круче идет кривая m = f(T). Поскольку S(пар) > S(ж), то убывание функции m(ж) = f(T) отразится на графике более пологой кривой, чем m(пар) = f(T).
, а S
всегда положительна. Чем больше S, тем круче идет кривая m = f(T). Поскольку S(пар) > S(ж), то убывание функции m(ж) = f(T) отразится на графике более пологой кривой, чем m(пар) = f(T).
Энтропия жидкой воды меньше, чем энтропия пара S(ж)<S(пар) и при Ткип. энтропия меняется скачком: S(пар) – S(ж) = DS(исп.).
22. Ответ
Уравнение зависимости Тпл. = f(P) можно получить из уравнения Клаузиуса-Клапейрона для равновесия Т = Ж
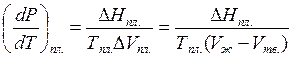 ,
, 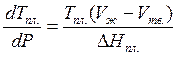 . Поскольку DНпл.> 0, то
характер изменения Тпл. с давлением зависит от знака DV: если Vж > Vтв. для вещества А, то
. Поскольку DНпл.> 0, то
характер изменения Тпл. с давлением зависит от знака DV: если Vж > Vтв. для вещества А, то 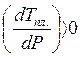 и с
повышением давления Тпл. увеличится. Если же Vж <Vтв. для вещества В (как у воды), то DV< 0,
и с
повышением давления Тпл. увеличится. Если же Vж <Vтв. для вещества В (как у воды), то DV< 0, 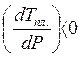 и с повышением
давления Тпл. понизится.
и с повышением
давления Тпл. понизится.
23. Ответ
Нет, эта форма уравнения является
частным случаем уравнения Клаузиуса-Клапейрона: 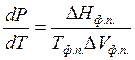 . Оно может
быть применено к процессам возгонки твердого вещества и испарения жидкости,
когда DV »Vп (Vп >>Vтв. и
Vп >>Vж) и
пар ведет себя как идеальный газ Vп =
. Оно может
быть применено к процессам возгонки твердого вещества и испарения жидкости,
когда DV »Vп (Vп >>Vтв. и
Vп >>Vж) и
пар ведет себя как идеальный газ Vп = ![]() , тогда
, тогда 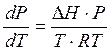 или
или 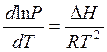 .
.
24. Ответ
При изменении температуры
индивидуального вещества меняется его агрегатное состояние, т.е. происходят
фазовые переходы. В изобарно-изотермическом процессе перехода вещества из
состояния 1 в состояние 2 DG = G2 – G1 £ 0, и, следовательно, процесс возможен, если G2 <G1 , при этом
вещество переходит из фазы 1 с бόльшим значением энергии Гиббса G1 в фазу 2 с меньшим значением G2. При Т = Тф.п.
DG = 0, т.е.
переход вещества из одной фазы в другую не сопровождается изменением энергии
Гиббса и может происходить в обоих направлениях, при этом две фаза (два
агрегатных состояния) находятся в равновесии. Для каждого агрегатного состояния
G является функцией температуры: Gтв.(Т), Gж(Т), Gг(Т),
но по-разному изменяются с температурой, поскольку производная энергии Гиббса
по температуре 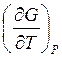 = –S, а
энтропия разных агрегатных состояний существенно различаются: Sтв<Sж<Sг. В соответствии
с этим убывание функции Gтв.(Т)
на графике отразится более пологой кривой, чем функция Gж(Т), а последней, в свою очередь, - более пологой
кривой, чем Gг(Т).
При определенных значениях температуры эти зависимости G(Т) пересекаются: при температуре отвечающей
точке пересечения кривых Gтв.(Т)
и Gж(Т), DG = 0, в равновесии находятся твердая и жидкая фазы, и
таким образом, эта точка является точкой плавления (Тпл.).
В точке пересечения кривых Gж(Т)
и Gг(Т) при определенном
давлении будут сосуществовать жидкая и газообразная фазы, и это будет точка
кипения (Ткип.) при заданном давлении. При Т'
< Тпл. устойчивой является твердая фаза,
т.к. Gтв.< Gж, а при Т'' < Тпл –
жидкая фаза, т.к. Gж. < Gтв..
= –S, а
энтропия разных агрегатных состояний существенно различаются: Sтв<Sж<Sг. В соответствии
с этим убывание функции Gтв.(Т)
на графике отразится более пологой кривой, чем функция Gж(Т), а последней, в свою очередь, - более пологой
кривой, чем Gг(Т).
При определенных значениях температуры эти зависимости G(Т) пересекаются: при температуре отвечающей
точке пересечения кривых Gтв.(Т)
и Gж(Т), DG = 0, в равновесии находятся твердая и жидкая фазы, и
таким образом, эта точка является точкой плавления (Тпл.).
В точке пересечения кривых Gж(Т)
и Gг(Т) при определенном
давлении будут сосуществовать жидкая и газообразная фазы, и это будет точка
кипения (Ткип.) при заданном давлении. При Т'
< Тпл. устойчивой является твердая фаза,
т.к. Gтв.< Gж, а при Т'' < Тпл –
жидкая фаза, т.к. Gж. < Gтв..
25. Ответ
Температура фазовых переходов, как
первого, так и второго рода является функцией давления. Для фазовых переходов I рода
(плавление, возгонка, испарение) эта зависимость описывается дифференциальным
уравнением Клаузиуса – Клапейрона для равновесного существования фаз: 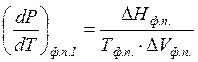 . Для фазовых
переходов II рода, где нет существования фаз, Р от Тф.п.II
выражается одним из уравнений Эренфеста:
. Для фазовых
переходов II рода, где нет существования фаз, Р от Тф.п.II
выражается одним из уравнений Эренфеста: 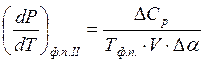 и
и 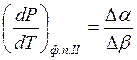 , где
, где 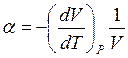 - коэффициент
термического расширения,
- коэффициент
термического расширения, 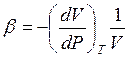 – изотермический коэффициент сжимаемости. Как
видно, зависимости Р = f (Tф.п.)
задаются с помощью тех термодинамических свойств, которые изменяются при
переходе от одной фазы к другой. В случае фазовых переходов I рода
это DНф.п. ≠ 0 и DVф.п. ≠0,
а для фазовых переходов II рода это DСр ≠ 0, Da≠
0, Db≠ 0. Интересно, что
последние величины – первые производные от тех, которые скачкообразно изменяются
при фазовых переходах I рода.
– изотермический коэффициент сжимаемости. Как
видно, зависимости Р = f (Tф.п.)
задаются с помощью тех термодинамических свойств, которые изменяются при
переходе от одной фазы к другой. В случае фазовых переходов I рода
это DНф.п. ≠ 0 и DVф.п. ≠0,
а для фазовых переходов II рода это DСр ≠ 0, Da≠
0, Db≠ 0. Интересно, что
последние величины – первые производные от тех, которые скачкообразно изменяются
при фазовых переходах I рода.
26. Ответ
При фазовых переходах I рода имеется возможность существования
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.