






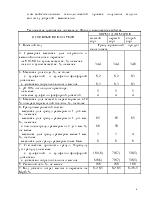














процессе охлаждения и кристаллизации аммиачная селитра несколько раз переходит из одной кристаллической формы в другую, каждое такое превращение сопровождается выделением тепла:
|
Температурный интервал охлаждения, °С 196,6 – 125,2 125,2 – 84,2 84,2 – 32,3 32,3 – ( – 16,9) Ниже – 16,9 |
Количество выделяемого тепла, ккал/кг 16,75 12,25 4,1 5,0 1,6 |
Если бы было возможно тепло расплава, а также тепло, использовать физическое выделяемое при кристаллизации, то готовую продукцию, содержащую выше 95% аммиачной селитры, можно было бы высушить до содержания влаги 0,1–0,2%. Однако для этого процесса нужен длительный промежуток времени. В современных же технологических процессах время превращения расплава в твердую соль исчисляется секундами.
Огнеопасность и взрывоопасность
Аммиачная селитра относится к взрывоопасным и огнеопасным веществам. Гранулы аммиачной селитры устойчивы к трению, ударам и толчкам, однако при воздействии детонатора или при нагревании в замкнутом пространстве аммиачная селитра взрывается. Взрывоопасность аммиачной селитры возрастает в присутствии кислот (азотной, серной, соляной и др.), органических веществ (масел, опилок, стружек, древесного угля и др.), некоторых металлов (алюминия, цинка, свинца, меди, никеля, кадмия и др.), особенно, если они находятся в порошкообразном состоянии. Наиболее опасными металлическими примесями к аммиачной селитре являются кадмий и медь. Аммиачная селитра, содержащая более 3% влаги, не взрывоопасна.
При получении, упаковке и хранении аммиачной селитры необходимо следить за тем, чтобы в нее не попадали примеси (масло, бумага, опилки, стружки и др.).
При температуре 100°С аммиачная селитра начинает разлагаться:
NH4NO3 = NH3+HN03–41,7 ккал.
Выделившиеся азотная кислота и аммиак в определенных условиях могут соединяться между собой, реакция сопровождается выделением тепла:
HNO3+NH3=N20+2H20+51,5 ккал.
Выделяющееся тепло разогревает аммиачную селитру, и, если она находится в слежавшемся состоянии и к тому же в замкнутом пространстве, может произойти взрыв:
2NH4N03=2NO+N2+4H20+13,7 ккал.
Эта реакция начинается при температуре 230°С и с повышением температуры развивается очень быстро.
Аммиачную селитру нельзя нагревать до высокой температуры: даже при осторожном нагревании до температур, превышающих 180°С, происходит ее разложение:
NH4N03=N20+2H20+8,8 ккал.
Добавление в аммиачную селитру некоторых неорганических соединений (стабилизаторов) предотвращает самопроизвольное разложение. Стабилизаторами являются мочевина CO(NH2)2 (1% от веса аммиачной селитры), карбонат кальция СаС03 или карбонат магния MgC03 (5% от веса аммиачной селитры) и др.
ТЕХНОЛОГИЯ ПРОИЗВОДСТВА ОПИСЫВАЕМОГО ТОВАРА И ЕЕ ТЕХНИКО-ЭКОНОМИЧЕСКАЯ ОЦЕНКА
ПРИНЦИПИАЛЬНАЯ СХЕМА ПРОИЗВОДСТВА АММИАЧНОЙ СЕЛИТРЫ
Процесс производства аммиачной селитры условно делят на четыре стадии:
· нейтрализация разбавленной азотной кислоты аммиаком,
· упаривание растворов нитрат аммония,
∙ кристаллизация расплава и охлаждение,
· упаковка и складирование готовой продукции.
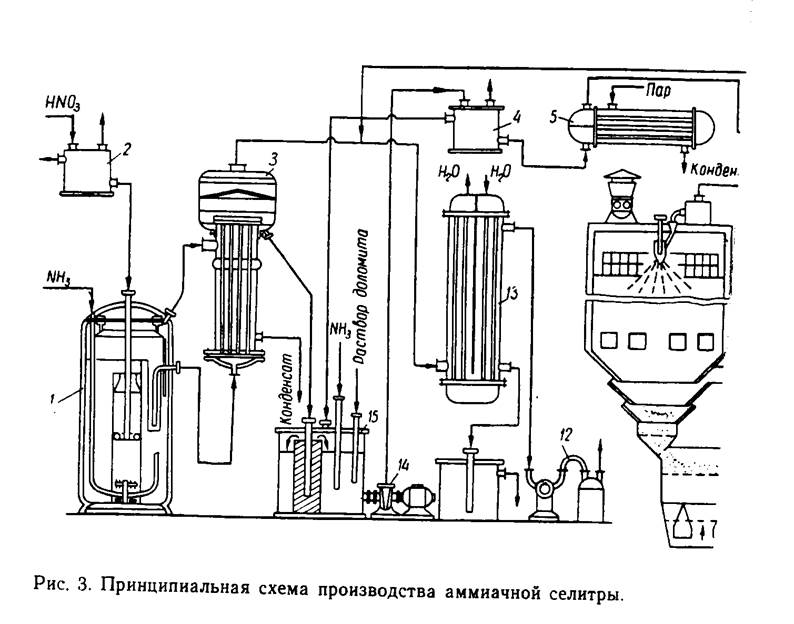
Азотная кислота поступает в напорный бак 2. Часть кислоты из напорного бака по переливной линии поступает во всасывающий патрубок насоса, подающего кислоту в напорный бак. Из него азотная кислота поступает в реакционный стакан нейтрализатора 1. Сюда же под давлением подается газообразный аммиак, постоянное давление которого на входе в нейтрализатор поддерживается с помощью регулятора давления. Образовавшийся в реакционном стакане раствор закипает за счет тепла реакции, и часть воды, поступившей с кислотой, переходит в пар. Парожидкостная смесь из реакционного стакана выбрасывается в испарительную часть нейтрализатора. Раствор опускается вниз и через окна поступает в реакционный стакан, т. е. происходит естественная циркуляция раствора между реакционной и испарительной частями нейтрализатора. Из нейтрализатора через гидравлический затвор поступает в трубки пленочного выпарного аппарата первой ступени 3. В выпарном аппарате первой ступени раствор упаривается до содержания в нем аммиачной селитры 85–87. Из выпарного аппарата первой ступени раствор через гидравлический
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.