Напомню, что закон Бугера-Ламберта-Бера (8) справедлив только для монохроматического излучения. Поэтому для проведения абсорбционного анализа необходимо знать или предварительно промерить спектр поглощения вещества. Кроме того, следует учитывать то, что интенсивности непосредственно падающего на анализируемое вещество i0(l)<I0(l) и вышедшего из него i(l)<I(l) излучения меньше значений, задаваемых законом Бугера. Это связано с отражением света от поверхности вещества и кюветы, в которой вещество находится, поглощением света окошками кюветы и растворителем. Поэтому одной из главных задач абсорбционного анализа является определение связи между отношениями измеряемых интенсивностей i(l)/i0(l) и отношениями интенсивностей в соответствии с законом Бугера I(l)/I0(l). Эта задача решается чисто экспериментально при помощи двух идентичных образцов разной длины, но с одинаковыми коэффициентами отражения их входных и выходных поверхностей. В этом случае отношения интенсивностей световых потоков, вышедших из разных кювет (образцов) равно
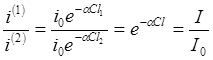 ,
(9)
,
(9)
где l=l1–l2. При измерении поглощения растворов необходимо учитывать поглощение самого растворителя. Для этого используют две тождественные кюветы, одна из которых заполняется раствором, а другая – чистым растворителем, коэффициент поглощения которого равен c(l). При отсутствии химического взаимодействия между растворенным веществом и растворителем отношение интенсивностей вышедшего из кювет света равно:
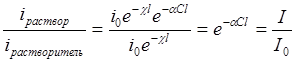 . (10)
. (10)
В
абсорбционной спектроскопии отношение 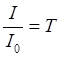 называется
коэффициентом пропускания, а его десятичный логарифм, взятый со знаком минус,
называется оптической плотностью
называется
коэффициентом пропускания, а его десятичный логарифм, взятый со знаком минус,
называется оптической плотностью ![]() . Величина 1-Т
называется коэффициентом поглощения. Концентрацию C
выражают в разных единицах. Для газов и растворов ее определяют как число
атомов или молекул в единице объема, обычно в кубическом сантиметре, и
обозначают N, а соответствующий ей показатель
поглощения обозначают g и называют
молекулярным. Концентрацию растворенного вещества обозначают обычно как C и измеряют числом грамм-молей в 1 литре раствора. В этом
случае показатель поглощения принято обозначать как e и называть молярным. Численная связь этих величин проста:
. Величина 1-Т
называется коэффициентом поглощения. Концентрацию C
выражают в разных единицах. Для газов и растворов ее определяют как число
атомов или молекул в единице объема, обычно в кубическом сантиметре, и
обозначают N, а соответствующий ей показатель
поглощения обозначают g и называют
молекулярным. Концентрацию растворенного вещества обозначают обычно как C и измеряют числом грамм-молей в 1 литре раствора. В этом
случае показатель поглощения принято обозначать как e и называть молярным. Численная связь этих величин проста:
![]() или
или 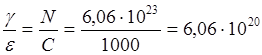 .
(11)
.
(11)
При
количественном абсорбционном анализе удобно пользоваться оптической плотностью D(l)
из-за того, что для многокомпонентного раствора, компоненты которого не
взаимодействуют друг с другом, полная оптическая плотность равна арифметической
сумме оптических плотностей всех компонент. Кривые D(l) зависят от толщины и
концентрации раствора, но логарифмические кривые ![]() для
одного и того же вещества сохраняют свою форму, а зависимость от C и l проявляется в
перемещении кривой параллельно себе вдоль оси ординат. Обычно логарифмический
тип кривых (зависимость от длины волны излучении) применяется для получения
стандартных данных и отождествления вещества.
для
одного и того же вещества сохраняют свою форму, а зависимость от C и l проявляется в
перемещении кривой параллельно себе вдоль оси ординат. Обычно логарифмический
тип кривых (зависимость от длины волны излучении) применяется для получения
стандартных данных и отождествления вещества.
Таким образом, абсорбционный анализ основан на спектрах поглощения и законе Бугера-Ламберта-Бера. Следует иметь в виду, что на практике возможны отклонения от этого закона, которые вызываются физико-химическими и инструментальными причинами. К первой группе причин относится возможность изменения природы поглощающих частиц при растворении вещества и смещение равновесия между диссоциированными компонентами растворенных веществ. Вторая группа причин обусловлена, главным образом, немонохроматичностью используемого света и разным качеством оптических кювет.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.