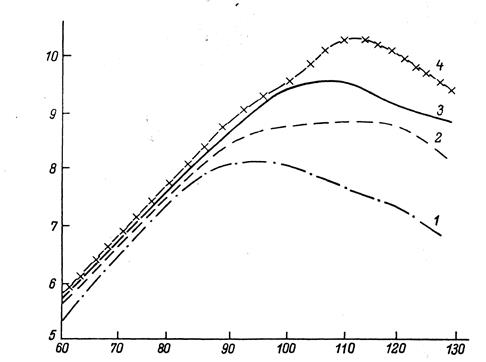
Рис. 7.6 – Зависимость производительности ИС от частоты сокращений при разном уровне диастолического разрежения (1, 2, 3, 4 – соответствуют уровням разрежения 0, 5, 10, 15 мм. рт. ст.)
В этих условиях не менее важным являются потери на пневмошланге и внутреннем сопротивлении пневмопривода. В таких экспериментах было показано, что потери на пневмошлангах длиной 2 м составляют 5–15 мм рт. ст. Поэтому для компенсации сопротивления пневмошланга на выходе пневмопривода необходимо поддерживать небольшое разрежение. Для исключения этих потерь и увеличения крутизны выходной характеристики ИС был разработан пневматический клапан, устанавливаемый в непосредственной близости от ИС при выходе пневмошланга из грудной клетки.
Резюмируя, можно отметить, что собственно ИС обладает свойствами саморегуляции сердечного выброса без применения методов автоматического управления. Однако крутизна выходной характеристики во многом определяется конструкцией ИС и пневмопривода. Поэтому основной целью разработки систем управления ИС, основанных на воспроизведении механизма Франка–Старлинга, является повышение крутизны выходной характеристики ИС. При этом наметилось два направления в разработке подобных систем. Одно из них, основано на первичном увеличении ударного выброса в ответ на увеличение давления на входе в желудочек, второе – на автоматическом увеличении частоты сокращений в ответ на увеличение давления на входе в желудочек при работе в режиме полного заполнения и опорожнения, т. е. в режиме постоянного ударного выброса.
Преимущества систем автоматического управления ИС с полным ударным выбросом и переменной частотой сокращения авторы видят в более полной циркуляции крови внутри желудочков, что уменьшает вероятность образования тромбов. Кроме того, объем желудочков может быть уменьшен для получения необходимой производительности ИС по сравнению с желудочками, работающими в режиме неполного выброса. Хотя частота сокращений может быть в последнем случае установлена достаточно высокой, чувствительность сердечного выброса к входному давлению является обратной функцией частоты сердечных сокращений.
На рис. 7.7 представлена блок-схема системы управления длительностью фазы нагнетания в зависимости от скорости наполнения желудочка. Рассмотрим работу левого канала управления.
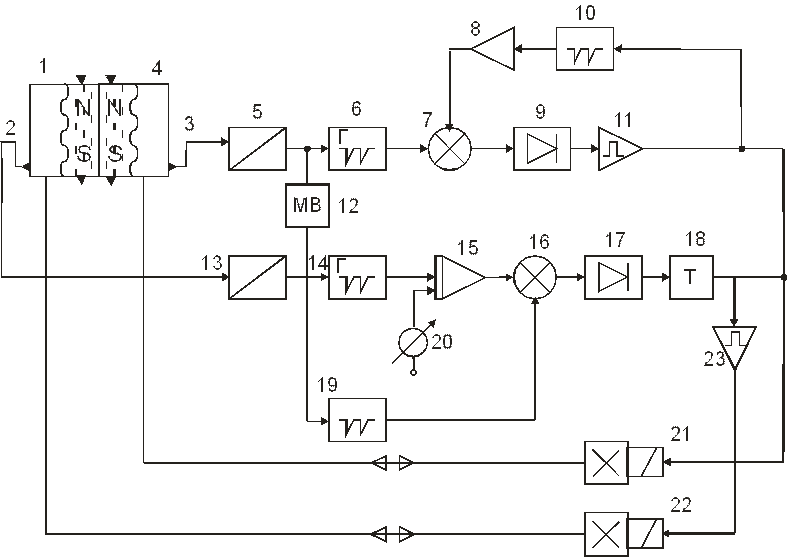
Рис. 7.7 – Блок–схема системы автоматического управления искусственным кровообращением
При заполнении левого желудочка (4) кровью магнит, вмонтированный в рабочую диафрагму со стороны пневмокамеры, замыкает контакты геркона (3), установленного в корпусе левого желудочка. Сигнал с геркона через нормализатор (5) запускает генератор линейно падающего напряжения (6). Напряжение генератора (6) сравнивается с помощью компаратора (7) с напряжением, пропорциональным частоте сокращений и длительности фазы всасывания левого желудочка. Это напряжение получается за счет усреднения сигналов генератора линейно нарастающего напряжения (10). Последний запускается по окончании фазы нагнетания и сбрасывается в момент начала фазы нагнетания. Компаратор (7) срабатывает, когда напряжение генератора (6) превышает напряжение на выходе усреднителя (8). На выходе компаратора, выполненного по типу блокинг-генератора с обмотками положительной и отрицательной обратной связи, формируется пакет высокочастотных импульсов, которые выпрямляются детектором (9). Импульсы на выходе детектора усиливаются усилителем мощности (11) и подаются на электропневмоклапан (21) управления левым желудочком.
Таким образом, левый канал определяет частоту и длительность сокращений ИС. При увеличении, например, давления на входе в левый желудочек он будет заполняться быстрее. Напряжение на выходе генератора (6) уменьшится. При этом длительность фазы нагнетания увеличивается, приводя к увеличению ударного выброса и нормализуя увеличение частоты сокращений левого желудочка.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.