Главной характеристикой порошкового профиля было наблюдение очень четких рефлексов от высококристаллического образца белка. С помощью набора ограничений и измерением дифракционного профиля удалось уточнить положение 1260 атомов белка. Для того, чтобы провести этот эксперимент Von Dreele усовершенствовал программное обеспечение GSAS (Larson & VonDreele, 2004). Был добавлен новый набор стереохимических ограничений вместе с автоматической распознавание атомов и типов связей для стандартных аминокислотных остатков к ограничениям, которые использовались для монокристалла при низком разрешении. Новые ограничения были введены для описания двумерной псевдопотенциальной поверхности (Ramachandran etal.,1963). Так же, Babinet начальная коррекция на растворитель была использована для расчета в случае беспорядочного включения растворителя в кристаллическую структуру. Великолепные результаты Rietveld были прорывом, впрвый раз показавшим, что расшифровка кристаллической структуры белка может быть проведена с помощью порошковых данных.
В последующие годы новый вариант T3R3 Zn-инсулинового комплекса человека, полученного с помошью механического гриндинка для поликристаллического образца был расшифрован с помощью порошка (VonDreele etal.,2000). Рентгеновские синхротронные данные высокого разрешения так же использовались для расшифровки кристаллической структуры путем модельного приближения. Стратегия расшифровки кристаллической структуры состоит из следующих шагов:
1. Индецирование порошковой диаграммы с выявлением дублирования по оси С
2. предположение, что начальная структурв как в модели исходя из координат монокристалла T3R3 комплекса (Ciszak & Smith, 1994).
3. Расположение двух T3R3 комплексов в удвоенной ячейке по оси С, один по оси с в 0, второ в z = ½.
4. Врашение вдоль оси С от - 15 до + 15 град для двух групп соответственно
5. Rietveld подгонка по трем параметрам (два угла вращения и одна трансляция)
Полное решения для 1630 атомов белка бло получено комбиированием 7981 стереохимического ограничения и сравнения модели с экспериментальными данными.
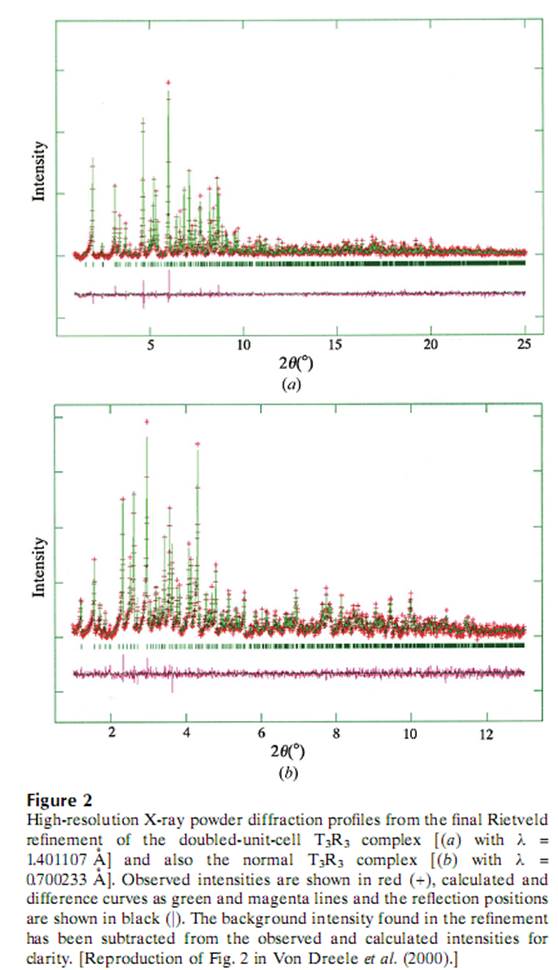
Подгонка показана на рисунке 2 весте с моделью известной ранее.
На рисунке 3 изображена модель спроецированная на ось С. Было определено, что обратимое изменение фазы, включающее в себя гриндинг происходит вместе с вращением на 9,5 и 17,2 град двух T3R3 комплексов, которые составляют кристаллическую структуру. Эти же результаты позднее были получены методом монокристальной дифракции при криогенной температуре (100 К). Значение здвига по оси С между порошковой и монокристальной структурами составило 1,36 A, Которое незначительно, относительно низкого разрешения порошковой структуры и того, что данные были собраны при комнатной температуре.
Так же не в монокристальном эксперименте не было гриндинга,
изменение фазы было обеспечено увеличением давления. 
Возможность использования данных порошковой дифракции микрокристаллических белков для определения лигандов в белок-лиганд комплексах была показана изучением HEWL комплексов с N-ацетилглюкозамин(NAGn, n =1-6) олигосахаридами Все (Von Dreele,2001,2005). Все данные порошковой дифракции белков в этих исследованиях показали очень четкие пики Брега согласующиеся с размерок кристаллитов более, чем 1 мкм, которые так же не имели линейно-протяженных дефектов. Расположение каждого NAGn может быть определено из различных карт Fourier полученных из структурных факторов извлеченных из предварительных подгонок Rietveld. Полные NAG-nprotein структуры были подвергнуты подгонки с помощью комбинации стериохимических и Rietveld ограничений показала связанное поведение для NAGn в зависимости от длинны олигосахарида.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.