
Кривобоков И.М.
Генералов М.В.
Цель работы: Волюмометрическим методом изучить кинетику реакции разложения (диспропорционирования) Н2О2 в присутствии аква-ионов Fe2+ в гомогенных условиях (рН растворов в областях 1-3)
Теория:
Перекись водорода достаточно легко диспропорционирует на воду и молекулярный кислород по уравнению:
2Н2О2 = 2Н2О+О2 (1)
Эта реакция ускоряется под действием излучений, например, ультрафиолетового света, а также в присутствии гетерогенных (стекло, уголь, многие металлы и их соли и окислы) и гомогенных (например, растворимые соединения переходных металлов) катализаторов.
Гомогенный катализ диспропорционирования перекиси водорода в присутствии соединений железа изучен наиболее подробно и глубоко, хотя и в этом случае на некоторые вопросы, касающиеся механизма реакции (1) не получено однозначного ответа. На сегодняшний день экспериментально более обоснованным считается циклический ион-радикальный (не цепной) механизм диспропорционирования перекиси водорода в системе "аква-ионы Fe2+-Н2О2" (реагент Фентона), включающий в общем случае следующие стадии:
1) Fe2+ + H2O2 = Fe3+ + .OH + OH-
2) Fe2+ + .OH = Fe3+ + OH-
3) .OH + H2O2 = HO2. + H2O
4) Fe3+ + HO2. = Fe2+ + O2 + H+
5) Fe3+ + .O2- = Fe2+ + O2
6) Fe2+ + HO2. = Fe3+ + HO2-
Особенностью данного типа механизма является невозможность выделить стадии продолжения цепи, а ответственные за разложение перекиси водорода активные частицы – ионы Fe2+ , Fe3+ и радикалы .OH, HO2., .O2- образуются и расходуются в результате циклического процесса. При этом вся совокупность стадий 1-6 реализуется лишь при условии 0,5 < [H2O2]/[Fe2+]< 200; при 200 < [H20]/[Fe2+] < <1 • 104 протекают только стадии 1,3,4,5 и 6.Наконец, в случае [Fe2+]/[H2O2]≥ 2 схема механизма включает лишь две реакции - 1 и 2,отражающие процесс стехиометрического окисления Fe2+ в Fe3+ при этом длспропорционирование Н2О2 не протекает вовсе. Поскольку в ходе процесса каталитического диспропорционирования Н2О2 по брутто-реакции (1) выделяется молекулярный кислород (так, при разложении 1 г Н2О2 при комнатной температуре образуется около 360 мл O2) простым, удобным и весьма чувствительным средством слежения за кинетикой реакции является волюмометрический метод. При применении данного метода было установлено, что скорость газовыделения W2° в системе “Fe - Н2О2” растет прямо пропорционально концентрациям Fe2+ и Н2О2 (однако при [Н2О2] > 1,0 М, [H2O2]/[Fe2+] = 25, W2° перестает зависеть от H2O2). Показано также, что W2° растет с увеличением рН раствора, что связывают с конкуренцией стадий 4 и 5.Однако следует иметь в виду, что с ростом рН раствора интенсивно начинают протекать процессы гидролиза ионов Fe3+; при этом при рН > 3,5 можно наблюдать переход от гомогенного течения реакции к гетерогенному с участием слаборастворимых основных солей Fe3+ и, как следствие, уменьшение скорости реакции.
Практика:
Исходя из предположения что реакция:
2Н2О2 → 2Н2О + О2
a-2x x
имеет 1 порядок по [Н2О2] получаем кинетическое уравнение:
-d[Н2О2]/dt = kэфф*[ Н2О2], где kэфф – эффективная константа скорости реакции,a – исходное количество Н2О2 в растворе, x – число молей О2 образовавшегося к моменту времени t.
После преобразований получаем :
dx/dt = kэфф*(a/2 - x)= kэфф*(x0 – x), где x0-число молей О2 которое можно получить про полном разложении a молей Н2О2.
Поскольку при фиксированных температуре и давлении х пропорционально объему V выделившегося О2 имеем:
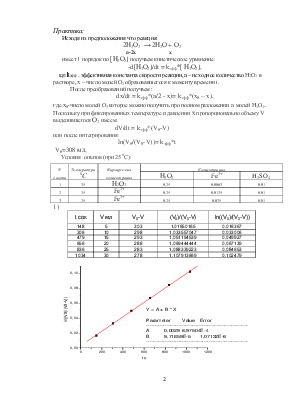
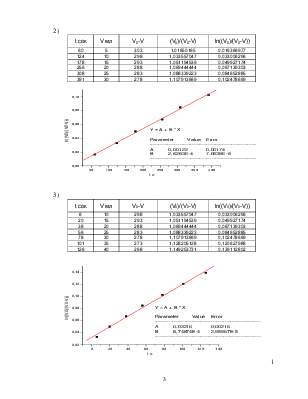
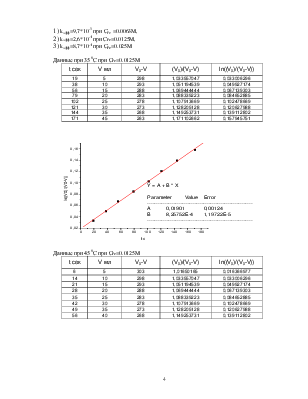
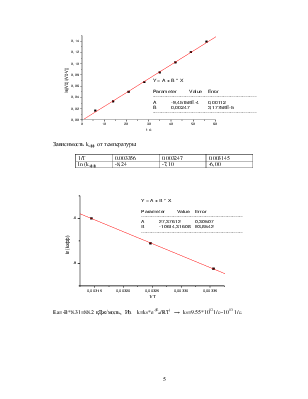
dV/dt = kэфф*(V0-V) или после интегрирования:
ln(V0/(V0-V))= kэфф*t
V0=308 мл,
Условия опытов (при 25 0С):
|
N опыта |
Температура 0С |
Варьируемая концентрация |
Концентрация |
||
|
Н2О2 |
Fe2+ |
H2SO4 |
|||
|
1 |
25 |
Н2О2 |
0.25 |
0.0063 |
0.01 |
|
2 |
25 |
Fe2+ |
0.25 |
0.0125 |
0.01 |
|
3 |
25 |
Fe2+ |
0.25 |
0.025 |
0.01 |
1)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.