Новосибирский государственный университет
Лабораторная работа по химической кинетике
Тема: Гомогенный катализ диспропорционирования Н2О2
аква-ионами Fe2+. Волюмометрический метод.
Выполнили:
Ст. 341 гр. Марцинкевич Владислав
Ст. 341 гр. Ющенко Дмитрий
Проверил: Калинкин Пётр Николаевич
Новосибирск 2006
1. Цель работы: Изучение гомогенного катализа в реакции диспрпорционирования пероксида водорода.
2. Теоретическая часть:
Реакция диспропорционирования Н2О2.
Легкость разложения перекиси водорода на воду и молекулярный кислород является характерным свойством этого соединения:
2Н2О2 → 2Н2О + О2
Реакция ускоряется под действием излучений, например, ультрафиолетового света, а также в присутствии гетерогенных и гомогенных катализаторов.
Гомогенный катализ диспропорционирования перекиси водорода в присутствии соединений железа изучен наиболее подробно и глубоко, хотя и в этом случае на некоторые вопросы, касающиеся механизма реакции, не получено однозначного ответа. На сегодняшний день экспериментально более обоснованным считается циклический ион-радикальный механизм диспропорционирования перекиси водорода в системе « аква-ионы Fe2+ - H2O2 » (реагент Фентона), включающий в общем случае следующие стадии:
1. Fe2+ + Н2О2 → Fe3+ + .ОН + ОН-
2. Fe2+ + .ОН → Fe3+ + ОН-
3. .ОН + Н2О2 → НО2. + Н2О
4. Fe3+ + НО2. → Fe2+ + О2 + Н+
4”. Fe3+ + О2.- → Fe2+ + О2
5. Fe2+ + НО2.→ Fe3+ + НО2-
Особенностью данного типа механизма является невозможность выделить стадии продолжения цепи, а ответственные за разложение перекиси водорода активные частицы – ионы Fe2+ , Fe3+ и радикалы. ОН, НО2.(О2.-).
Вся совокупность стадий 1-5 реализуется лишь при условии 0,5 < [Н2О2]/[Fe2+] <200; при 200 < [Н2О2]/[Fe2+] <<1*104 протекают стадии 1, 3, 4(4’) и 5, наконец, в случае [Fe2+]/[Н2О2] ≥ 2 схема механизма включает лишь две стадии – 1 и 2, отражающие процесс стехиометрического окисления Fe2+ в Fe3+ , при этом диспропорционирование Н2О2 не протекает вовсе. Поскольку в ходе процесса каталитического диспрпорционирования Н2О2 по брутто-реакции выделяется молекулярный кислород, простым, удобным и весьма чувствительным способом слежения за кинетикой реакции является волюмометрический метод. При применении данного метода было установлено, что скорость газовыделения W2o в системе “Fe2+ - Н2О2” растет прямо пропорционально концентрациям Fe2+ и Н2О2. Показано также, что W2o растет с увеличением pH раствора, что связывают с конкуренцией стадий 4 и 4” .
В данной работе изучается кинетика реакции разложения Н2О2 в присутствии аква-ионов Fe2+ в гомогенных условиях (pH растворов в областях 1-3) волюмометрическим методом.
3. Экспериментальная часть:
Приготовили растворы примерно нужных концентраций Fe2+ и Н2О2 и определили точное содержание компонентов титрованием.
Провели три эксперимента с варьированием концентрации и Н2О2. Полученные данные приведены ниже.
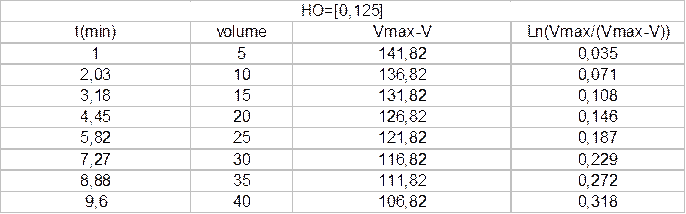
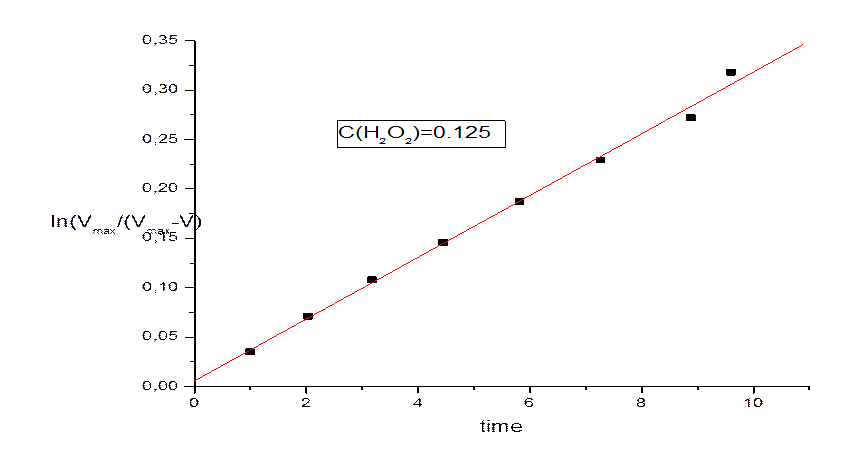 Y = A + B * X
Y = A + B * X
Parameter Value Error
-----------------------------------------------------------A 0,0058 0,0052
B 0,031 1E-3
В данном случае kэфф составляет 0,031 мин-1.

Y = A + B * X
Parameter Value Error
-----------------------------------------------------------A -0,012 0,004
B 0,081 0,001
В данном случае kэфф составляет 0,081 мин-1

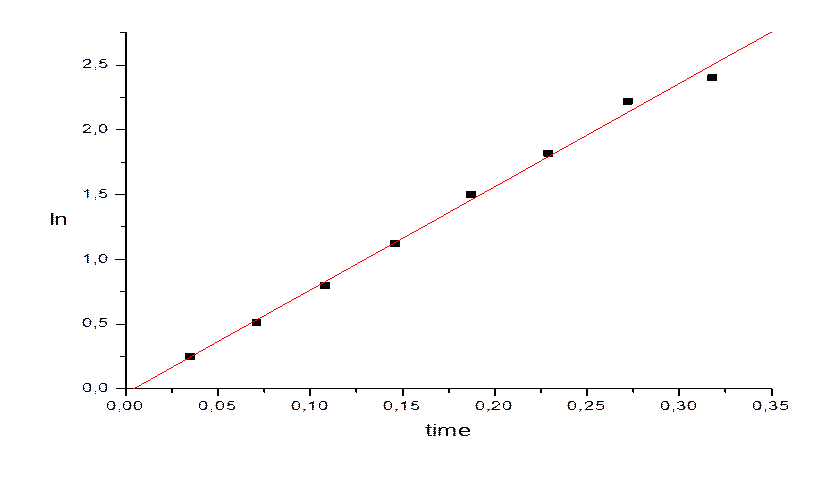
Y = A + B * X
Parameter Value Error
-----------------------------------------------------------A -0,1 0,04
B 7,9 0,2
Следующий этап эксперимента:
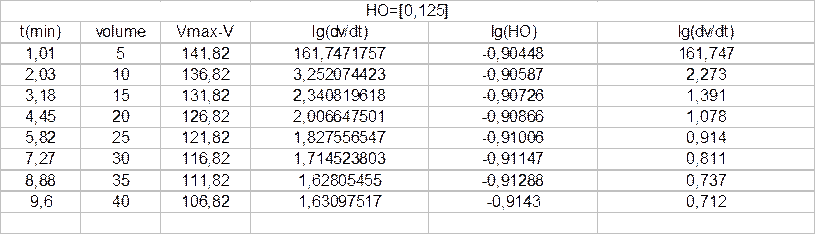
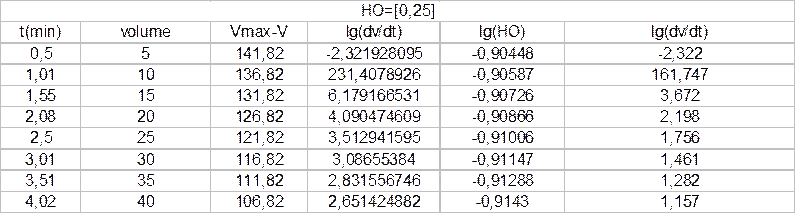

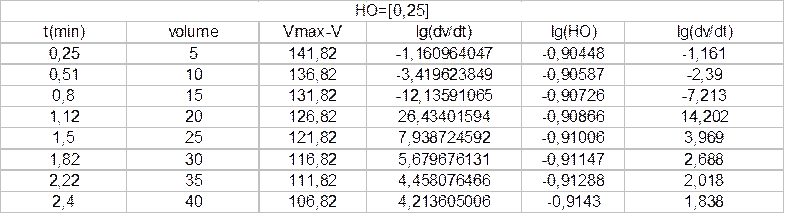

Таким образом было показано, что исследуемая реакция имеет первый порядок по перекиси водорода, является каталитической, кроме того была определена kэф.
После работы появились навыки практической работы с газоволюметрической установкой м навыки изучения кинетик реакций. Работу можно считать выполненной успешно, полученные результаты хорошо согласуются со справочными данными.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.