Новосибирский государственный университет
Кафедра физической химии
С-5. Определение константы скорости автокаталитической реакции окисления щавелевой кислоты перманганатом калия.
Выполнили:
студенты 441 группы
Ломовский Игорь
Наторхина Ксения
Проверила:
Новосибирск
2007
Автокатализом, называется явление, когда каталитическое действие на реакцию оказывает один из её продуктов. Для автокаталитической реакции характерно, что процесс идет при нарастающей концентрации продуктов. Поэтому скорость реакции в начале возрастает и лишь на более глубоких стадиях начинает идти на убыль в результате уменьшения концентраций реагентов. Кинетическая кривая для таких реакций имеет S – образный вид.
Примером такой реакции служит реакция автокаталитического окисления щавелевой кислоты перманганатом калия. Эта реакция протекает по сложному механизму, но лимитирующей стадией является образование ионов Mn3+ по реакции:
MnO4- + Mn2+ → MnO42- + Mn3+
Который быстро окисляет щавелевую кислоту с образованием CO2 и Mn2+. В это же время происходит диспропорционирование образующегося манганата с образованием MnO2. Тогда брутто – реакция будет выглядеть как
2MnO4- + 4H2C2O4 → Mn2+ MnO2+ 8CO2 + 2 H2O + 4 OH-
Скорость данной реакции окисления равна скорости лимитирующей стадии и пропорциональна произведению концентраций MnO4- и Mn2+ и описывается уравнением
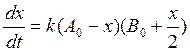
Где A0 – начальная концентрация пермарганата
B0 – начальная концентрация иона марганца
Интегрируя это выражение и заменяя 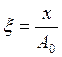 и
и
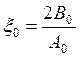 получаем
получаем
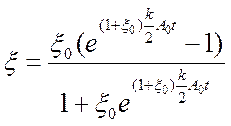
Считая, реакция у нас происходила без затравки, т.е A0 >> B0 и поиграв с уравнением получим
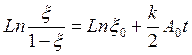
Т.е построив данную зависимость
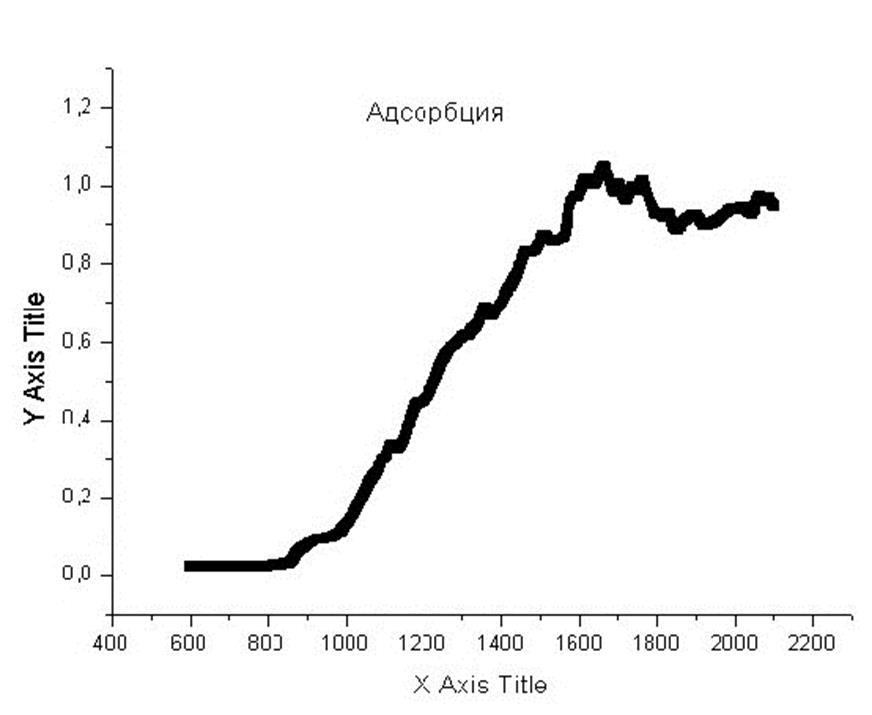
На практике удобнее всего измерять глубину реакции по
величине абсорбции образующегося диоксида марганца, у которого есть характерная
полоса поглощения на 430 нм. Тогда экспериментально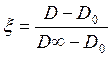
D0 = 0,24
D∞ = 0,94
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.