Однако, уравнение (3) в нашем случае сильно не изменится, в нем останется обратная зависимость от концентрации лиганда (в нашем случае Cl-). А значит, что при достижении достаточно большой концентрации Cl- E1 станет меньше, чем E2 и E3, что и будет означать, что окислительно-восстановительная реакция не пойдет, а наше соединение будет стабилизировано.
Синтезируемое соединение само по себе не несет никакого практического значения, так как, хоть и устойчивее, чем просто тетрахлорид свинца, но все равно является сильным окислителем и устойчиво лишь до 130 градусов в сухой атмосфере, поэтому храниться должно в запаянных ампулах.[8] Однако раньше оно было промежуточным соединением в синтезе тетрахлорида свинца по методу Фридриха[6]. Полученный таким образом тетрахлорид, который является легколетучей жидкостью, перегоняли,восстанавливали и получали свинец высокой очистки, который использовался при изготовлении первых экранов электронно-лучевых трубок.[11]
Экспериментальная часть.
В справочнике: Брауэр “Руководство по неорганическому синтезу”, т.4. стр 838. описаны два метода синтеза (NH4)2[PbCl6]. Первый предполагает электрохимическое получение H2[PbCl6] в солянокислом растворе, с последующим добавлением в полученный раствор NH4Cl. Однако лаборатория, в которой проводился синтез, не имела в своем распоряжении оборудования для электролиза поэтому пришлось синтезировать химическим методом:
Для синтеза H2[PbCl6] была собрана установка:
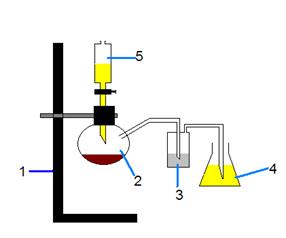
1. Штатив
2. Колба Вюрца с окислителем
3. Склянка Дрекселя с H2O дист.
4. Коническая колба с веществом
5. Капельная воронка с HClконц.
6,03 г PbCl2 растерто в ступке сначала в сухом виде, а потом с 5 порциями HClконц. по 12 мл, помещая получающуюся взвесь в коническую колбу (4), затем долито еще 30 мл HClконц.
В качестве окислителя в колбу Вюрца (2) сначала был помещен CaOCl2, но из-за того, что он был старый, а капельная воронка не была герметичной, Cl2 не выделялся. После замены воронки и смены CaOCl2 на KMnO4, реакция пошла:
2KMnO4 + 16HClконц. = 2KCl + 2MnCl2 + 8H2O + 5Cl2↑
При пропускании Cl2 через раствор в течение 1,5 часов при взбалтывании каждые 15 минут раствор стал желтым, а начальный осадок PbCl2 растворился:
PbCl2 + Cl2 + 2HCl = H2[PbCl6]
Получившийся раствор кислоты был охлажден до 5 С° на ледяной бане.
Одновременно был приготовлен раствор NH4Cl (24 г в 24 мл H2O) и тоже охлажден до 5 С°.
Получившиеся растворы были слиты:
H2[PbCl6] + 2NH4Cl = (NH4)2[PbCl6]↓ + 2HCl
Выпал ярко-желтый осадок синтезируемого вещества. Раствор оставлен еще на 1,5 часа на льду для кристаллизации. Получившийся осадок отфильтрован на стеклянном фильтре ( пористость 100 ), промыт заранее охлажденным абсолютным этиловым спиртом (20 мл) и эфиром (25 мл). Оставлен сушиться в выпарительной чашке в эксикаторе в течение семи дней.
Через неделю взвешен сухой осадок, m = 6,510 г.
Теоретический расчет.
Cl2 и HCl в избытке по условию синтеза.
υ (PbCl2) = 6,03/(207+71) = 0,0217 моль
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.