З А Н Я Т И Е N 6
ТЕМА: Биологически важные реакции карбонильных соединений
(альдегиды и кетоны). Реакции окисления
1. ЗНАЧИМОСТЬ ИЗУЧАЕМОЙ ТЕМЫ: Соединения, содержащие карбонильную группу >С=О, в зависимости от характера связанных с ней заместителей, делятся на альдегиды, кетоны, карбоновые кислоты и их функциональные производные. В альдегидах наряду с углеводородным радикалом карбонильная группа обязательно связана с атомом водорода и в целом группу
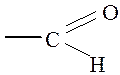
называют альдегидной. В кетонах оба заместителя имеют углеводородную природу.
Для альдегидов и кетонов характерны реакции нуклеофильного присоединения (взаимодействие с водой, спиртами, тиолами, аминами, реакции альдольной и кротоновой конденсации и др.), которые являются основой их функционирования in vivo.
2. ЦЕЛЬ ЗАНЯТИЯ: Сформировать знания химических свойств карбонилсодержащих соединений для понимания их реакционной способности обуславливающей протекание ряда реакций в биологических системах.
3. ЗАДАЧИ: после изучения темы
студент должен знать:
- классификацию и номенклатуру альдегидов и кетонов;
- особенности электронного строения карбонильной группы;
- важнейшие химические свойства альдегидов и кетонов, являющихся основой их биологического функционирования;
- механизм реакций нуклеофильного присоединения;
студент должен уметь:
- составлять структурные формулы альдегидов и кетонов и давать им названия по заместительной и радикально-функциональной номенклатуре;
- составлять уравнения реакций гидратации, ацетализации, альдольной и кротоновой конденсации альдегидов и кетонов и описывать их механизм;
- составлять уравнения реакций окисления, восстановления и диспропорционирования альдегидов и описывать их механизм;
- составлять уравнения реакций взаимодействия альдегидов и кетонов с аммиаком и аминами и описывать их механизм;
- составлять уравнения реакций гидролиза ацеталей и полуацеталей и описывать их механизм;
приобрести практические навыки:
- по составлению структурных формул альдегидов и кетонов;
- по составлению уравнений химических реакций с участием альдегидов и кетонов и описанию их механизмов;
- по выполнению качественных (аналитических) реакций на альдегиды и кетоны.
ОСНОВНЫЕ ВОПРОСЫ ТЕМЫ:
1. Оксогруппа >С=О, ее электронное строение и основные характеристики двойной связи (энергия, длина).
2. Реакции нуклеофильного присоединения, (AN) механизм.
3. Реакции присоединения-отщепления.
4. Реакции альдольного присоединения (альдольной конденсации).
5. Реакции диспропорционирования (реакция Канницаро-Тищенко).
ВСПОМОГАТЕЛЬНЫЕ МАТЕРИАЛЫ (ОСНАЩЕНИЕ ЗАНЯТИЯ)
1. Методические указания для студентов по теме "Биологически важные реакции карбонильных соединение (альдегиды и кетоны). Реакции окисления"
2. Учебные таблицы:
а) периодическая система химических элементов Д.И. Менделеева (1);
б) таблица старшинства функциональных групп по классификации ИЮПАК (12);
в) таблица "Электронные эффекты заместителей" (13);
г) химическая посуда: пробирки, пипетки, спиртовки, водяные бани;
д) реактивы, необходимые для проведения лабораторной работы.
МАТЕРИАЛЫ ДЛЯ КОНТРОЛЯ ЗА УСВОЕНИЕМ ТЕМЫ: тексты контрольных работ
МАТЕРИАЛЫ ДЛЯ САМОПОДГОТОВКИ СТУДЕНТОВ:
1. Напишите схемы реакций:
а) окисления муравьиного альдегида аммиачным раствором оксида серебра (реакция "серебряного зеркала");
б) восстановления уксусного альдегида и ацетона алюмогидридом лития LiAlH4. Какая частица выступает в роли нуклеофила?
в) пропионового альдегида с этиловым и пропиловым спиртом. Опишите механизм. Объясните роль кислотного катализатора и особенности полученных соединений в отношении к гидролизу.
2. Напишите уравнение реакции взаимодействия ацетона с синильной кислотой (HCN).
3. Напишите схему альдольной конденсации пропионового альдегида. Опишите механизм. Будут ли вступать в эту реакцию триметилуксусный альдегид? Какая структурная особенность предопределяет участие альдегидов в этой реакции?
4. Напишите схему диспропорционирования бензойного альдегида.
5. Напишите уравнение иодоформной реакции открытия ацетона.
ПЕРЕЧЕНЬ СОЕДИНЕНИЙ, ФОРМУЛЫ КОТОРЫХ НЕОБХОДИМО ЗНАТЬ:
1. Формальдегид 5. Иодоформ
2. Ацетальдегид 6. Ацетон
3. Акролеин 7. Бензальдегид
4. Глицериновый альдегид 8. Кротоновый альдегид
ОПЫТ 1. Отношение формальдегида и ацетона к окислению щелочными растворами оксидов тяжелых металлов
1) ОКИСЛЕНИЕ ГИДРОКСИДОМ СЕРЕБРА
Возьмите две пробирки и в каждую из них поместите по 2 капли 5% раствора нитрата серебра AgNO3 и 1 каплю 10% раствора гидроксида натрия NaOH. К полученному бурому осадку добавьте по каплям 10% водный раствор аммиака до полного его растворения. Затем в 1-ю пробирку прибавить 4 капли 40% формалина, а во 2-ю - 2 капли ацетона. В 1-й пробирке образуется осадок черного цвета, который при осторожном нагревании может выделяться на стенках пробирки в виде блестящего зеркального налета. Эта реакция носит название реакции "серебряного зеркала". Во 2-й пробирке выпадение осадка не наблюдается при обычных условиях.
ФОРМА ОТЧЕТА:
1. Напишите уравнение реакции "серебряного зеркала". Чем объясняется выпадение осадка черного цвета в 1-й пробирке?
2. Что произойдет с продуктами реакции при дальнейшем их окислении, т.е. при избытке окислителя? Напишите уравнение реакции.
2) ОКИСЛЕНИЕ ГИДРОКСИДОМ МЕДИ (II)
Поместите в каждую из двух пробирок по 8-10 капель 10% раствора гидроксида натрия и воды, добавьте по 1-5 капель 2% раствора сульфата меди CuSO4. К выпавшему осадку гидроксида меди (II) прибавьте в 1-ю пробирку 3-6 капель 40% раствора формалина, а во 2-ю - 3-5 капель ацетона. Пробирки осторожно нагрейте до кипения. В 1-й пробирке осадок приобретает сначала желтый цвет, затем - красный и , если пробирка чистая, на ее стенках может выделится металлическая медь ("медное зеркало").
Изменение осадков объясняется различной степенью окисления меди.
![]()
![]()
![]() Сu(ОН)2 СuОН Сu2О
Сu
Сu(ОН)2 СuОН Сu2О
Сu
окраска окраска окраска медь
ФОРМА ОТЧЕТА:
1. Наблюдается ли выпадение осадка во 2-й пробирке?
2. Напишите реакцию окисления формальдегида гидроксидом меди (II).
ОПЫТ 2. Получение оксима ацетона
В пробирку поместите по 1 лопаточке гидрохлорида гидроксиламина NH2OH.HCl и кристаллического карбоната натрия (на общем столе) и растворите в 10-25 каплях воды. После выделения основной массы диоксида углерода охладите пробирку и добавьте при хорошем перемешивании 15-20 капель ацетона. Смесь разогревается и выпадают белые кристаллы.
ФОРМА ОТЧЕТА:
Напишите схему реакции получения оксима ацетона и опишите механизм.
ОПЫТ 3. Открытие ацетона переводом его в иодоформ
Эта реакция используется в клинических лабораториях и имеет практическое значение для диагностики сахарного диабета.
В пробирку поместите 5 капель раствора иода в иодиде калия и прибавьте почти до обесцвечивания по каплям 10% раствор гидроксида натрия. К обесцвеченному раствору добавьте 1-3 капли ацетона. При слабом нагревании от тепла рук выпадает желтовато-белый осадок с характерным запахом иодоформа.
ФОРМА ОТЧЕТА:
1. Напишите уравнение реакции образования иодоформа.
2. Способен ли этиловый спирт образовывать иодоформ?
ОПЫТ 4. Реакция взаимодействия формальдегида с фуксинсернистой кислотой ( реакция Шиффа)
В две пробирки наливают по 1 мл бесцветного раствора фуксинсернистой кислоты и добавляют в одну из них несколько капель водного раствора формальдегида, а в другую - несколько капель ацетона. В первую пробирку добавляют осторожно 0,5 мл концентрированной НСl. Что наблюдается?
ФОРМА ОТЧЕТА:
1. Написать краткую методику проведения опыта.
ОПЫТ 5. Реакция диспропорционирования водных растворов
формальдегида (реакция Канниццаро).
Поместите в пробирку 2-3 капли 40% формальдегида и добавьте 1 каплю 0,2% раствора индикатора метилового красного. Что наблюдается?
ФОРМА ОТЧЕТА:
1. Написать краткую методику проведения опыта.
2. Написать уравнение реакции диспропорционирования формальдегида. Наличие какого соединения обуславливает кислую реакцию среды?
3. По какому механизму осуществляется реакция диспрорционирования формальдегида?
ОПЫТ 6. Реакция альдегидов с нитропруссидом натрия
В пробирку налить 1 мл воды и 2-3 капли ацетона. Затем добавить 1 мл 0,5% раствора нитропруссида натрия. После приливания нескольких капель 1н раствора гидроксида натрия смесь принимает красно-фиолетовую окраску, которая затем переходит в желтую.
ФОРМА ОТЧЕТА: 1. Написать краткую методику проведения опыта.
ОПЫТ 7. Окисление этилового спирта
В пробирку поместите 1мл раствора дихромата калия, добавьте столько же разбавленной серной кислоты и 1мл этилового спирта. Осторожно перемешайте, нагрейте - ощущается фруктовый запах уксусного альдегида. Раствор приобретает зеленую окраску от образования соли хрома (III)
ФОРМА ОТЧЕТА:
Напишите уравнение реакции окисления этилового спирта дихроматом калия в кислой среде. Укажите аналитический эффект реакции.
МАТЕРИАЛЫ УИРС:
Реакции нуклеофильного присоединения альдегидов и кетонов, протекающие в организме.
ЛИТЕРАТУРА
ОСНОВНАЯ:
1. Конспект лекций.
2. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия: Учеб. для студ. мед. институтов. - 2-е изд.перераб и доп. - М.: Медицина, 1991. - с. 181-194, 213-230.
3. Руководство к лабораторным занятиям по биоорганической химии/ Под ред. Н.А. Тюкавкиной. - М: Медицина, 1985. - с.92- 108, 128-137.
ДОПОЛНИТЕЛЬНАЯ:
1. Г. Тейлор. Основа органической химии для студентов нехимических специальностей. - М: Мир, 1989. - с. 113-141.
2. Степаненко Б.Н. Курс органической химии: Учеб.для студ. мед. институтов. - 3-е изд. перераб и доп. - М.: Высшая школа, 1979. - с. 183-207.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.