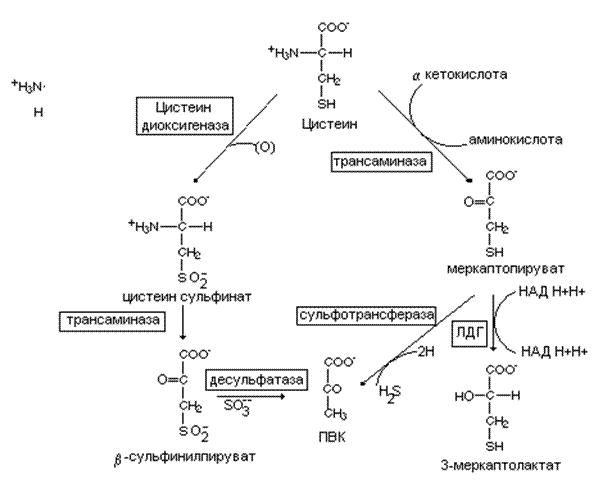
 |
С катаболизмом глицина тесно связан и обмен треонина. Альдолаза треонина –инициатор катаболизма этой аминокислоты. Под ее влиянием треонин распадается на молекулу глицина и уксусного альдегида. Уксусный альдегид восстанавливается при участии альдегиддегидрогеназы в уксусную кислоту, которую можно при помощи ацетаттиокиназы превратить в ацетилКоА. Второй путь катаболизма треонина включает специфическое дезаминирование этой аминокислоты при помощи серин-треонин дезаминазы, Образующийся при этом оксобутират может быть использован в синтезе аминокислот с разветвленным углеводородным радикалом.
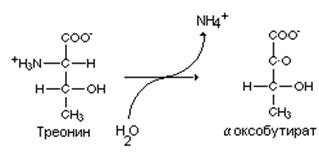
Глицинурия – состояние характеризующееся большими потерями глицина почками при нормальном уровне глицина в крови. Это состояние связывают с нарушением реабсорбции глицина почками.
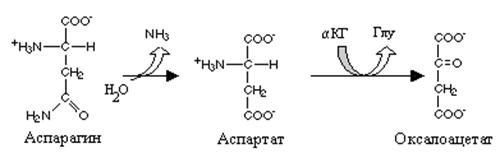
В оксалоацетат превращаются 2 аминокислоты аспарагин и аспарагиновая кислота. Два фермента катализируют это превращение. Аспарагиназа катализирует гидролитическое дезаминирование амидной группы аспарагина и образование аспарагиновой кислоты, а последняя под влиянием аспартатаминотрансферазы (АСТ) теряет аминогруппу и становится оксалоацетатом. Эта реакция обеспечивает цикл трикарбоновых кислот оксалоаце
 |
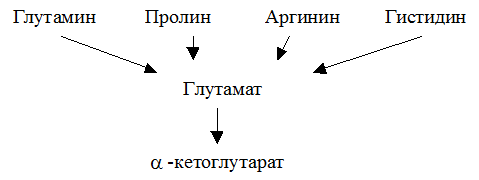
Глутаминовая кислота занимает важное место в промежуточном обмене нескольких аминокислот. К ним относятся глутамин, пролин, аргинин и гистидин.
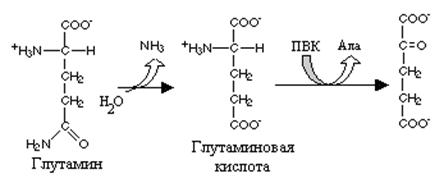
Реакция превращения глутамина в глутаминовую кислоту напоминает превращение аспарагина в аспарагиновую и катализируется глутаминазой. Учитывая, что глутамин - главная транспортная форма аммиака глутаминаза
 |
Продукты декарбоксилирования ароматических аминокислот и глутаминовой кислоты выполняют роль нейромедиаторов и многие лекарственные препараты, используемые для лечения неврологических и психических заболеваний оказывают влияние на метаболизм указанных соединений. Активная форма витамина В6 является коферментом декарбоксилаз, катализирующих эти реакции. Реакции декарбоксилирования необратимы.
Большая часть тирозина, который не используется в синтезе белков, распадается до конечных продуктов с высвобождением энергии. Однако небольшая его часть обеспечивает одну из важнейших функций этой молекулы – образование катехоламинов. Катехоламиновыми медиаторами являются дофамин, норадреналин, и адреналин
Норадреналин - основной нейромедиатор симпатических постганглионарных окончаний. И норадреналин и его метилированное производное, адреналин накапливаются в синаптических отделах нейронов, которые их секретируют.
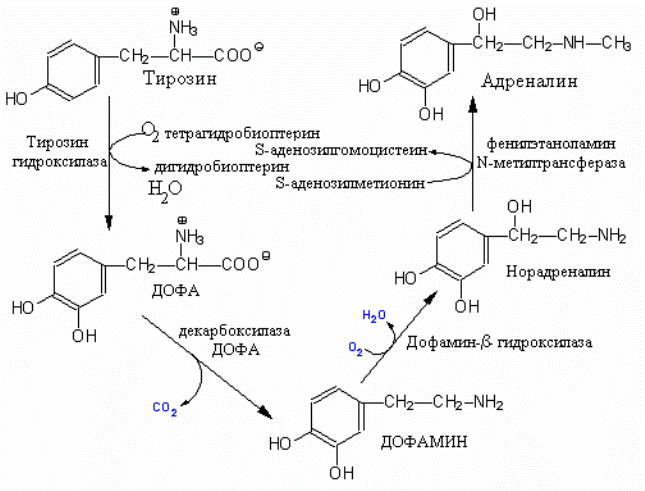 |
.Реакции синтеза катехоламинов.
катехоламинов. Первая реакция синтеза катализируется тирозин гидроксилазой, коферментом которой как и у фенилаланин гидро-
кислазы является тетрагидробиоптерин. Реакция гидроксилирования приводит к образованию ДОФА (3,4-дигидроксифенилаланина), который при помощи ДОФАдекарбоксилазы превращается в дофамин. Дофамин b-гидроксилаза катализирует еще одну реакцию гидроксилирования и продутом этой реакции является норадреналин. Последний под влиянием фенилэтаноламин N –метилтрансферазы превращается в адреналин. Эта реакция – одна из небольшого числа реакций в организме, которая использует SAM в качестве донора метильной группы , превращая последний в S-аденозилгомоцистеин. В нейронах substantia nigra и некоторых других областей мозга синтез продолжается только до дофамина, а в мозговом веществе надпочечников дофамин преобразуется в норадреналин и адреналин. После синтеза дофамин, норадреналин и адреналин упаковываются в секреторные пузырьки где с АТФ и белком, называемым хромогранином A..
Обмен катехоламинов происходит при участии катехоламин-O-метилтрансферазы, (КOMT) и тираминазы, (MAO). Оба эти фермента широко распространены в организме, хотя КОМТ не обнаружен в нервных окончаниях
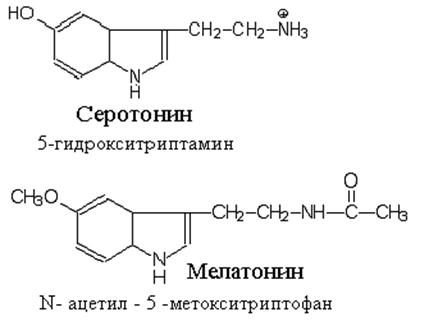
Серотонин синтезируется двуступенчатым процессом включающим тетрагидробиоптерин зависимую реакцию гидроксилирования (катализируемую триптофан- 5-монооксигеназой) и затем декарбоксилирование, катализируемое декарбоксилазой ароматических L-аминокислот. Гидроксилаза обычно не насыщается, поэтому увеличенное поступление триптофана с пищей может привести к увеличению содержания серотонина в мозге.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.