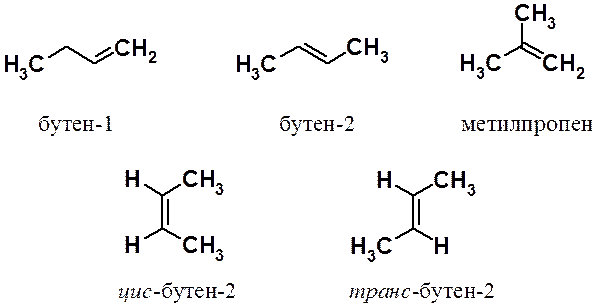
Использование цис- и транс- номенклатуры позволяет однозначно описать строение лишь тогда, когда этиленовым фрагментом связаны два типа одинаковых заместителей (в примере - СН3 и Н). Если при двойной связи более двух заместителей, то используют так называемую Е, Z-номенклатуру (от нем. Entgegen – напротив и Zusammen – вместе). В этом случае определяют взаимное расположение двух старших из имеющихся заместителей у разных углеродов двойной связи, причем старшими считаются заместители, имеющие большую молекулярную массу.
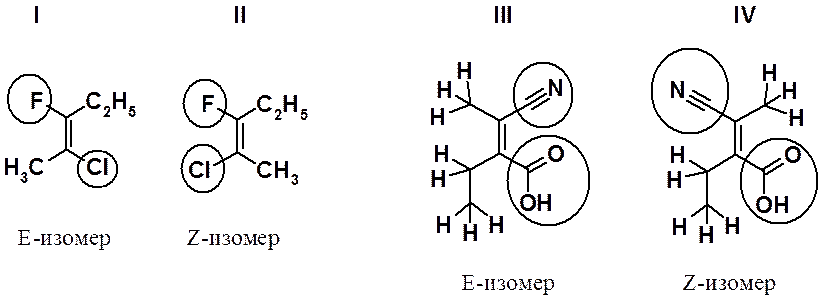
В паре соединений I и II конфигурацию молекулы определяют атомы галогена. У соединения I они расположены по разные стороны от двойной связи (Е-изомер), а у соединения II - по одну сторону (Z-изомер). В случае веществ III и IV определение старшинства заместителей провести сложнее, т.к. с тригональными углеродами связаны атомы углерода. В этом случае определение старшинства проводится по так называемому «второму слою», т.е. определяют старшинство заместителей, связанных с этими углеродами. В приведенном примере старшей группой будет СООН, затем – CN, третьей по старшинству – С2Н5 и самой младшей – СН3. Такое старшинство заместителей позволяет отнести соединения III и IV к E- и Z-изомерам соответственно.
В соответствии с номенклатурой IUPAC в качестве основы названия алкена выбирается самая длинная углеродная цепь, содержащая двойную углерод-углеродную связь. Затем следует определить, какому алкану она соответствует и использовать его название с заменой окончания –ан на -ен. Положение двойной связи указывается цифрой. Затем надо назвать заместители в боковой цепи и указать цифрами их положение.
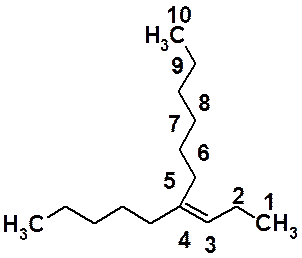
В примере цифрами показана самая длинная углеродная цепь, содержащая двойную связь. За основу названия выбран насыщенный углеводород декан. Непредельное соединение, соответственно - децен. Поскольку, двойная связь расположена между третьим и четвертым атомами С – децен-3. С пятым атомом углерода основной цепи связан углеводородный заместитель, состоящий из пяти атомов углерода - пентил. Полное название непредельного вещества 4-(пентил-1)-децен-3. Это соединение существует в виде пары E,Z-геометрических изомеров.
Основной промышленный источник алкенов – нефть. Низшие алкены (до 5 углеродов в цепи) в индивидуальном виде выделены при ее фракционной перегонке или крекинге.
Лабораторные методы получения алкенов позволяют получать в индивидуальном виде как высшие, так и низшие производные.
Более общее применение при получении алкенов имеют реакции дегалогенирования моногалогенопроизводных и дегидратация спиртов.
Действие на алкилгалогенид раствора едкой щелочи в этаноле приводит к элиминированию (отщеплению) молекулы галогеноводорода с образованием алкена. Реакция элиминирования будет рассмотрена в следующих разделах. Здесь необходимо отметить, что следует точно выдерживать условия реакции. Использование не спиртового, а водного раствора щелочи приводит к протеканию конкурентной реакции гидролиза с образованием соответствующего спирта.
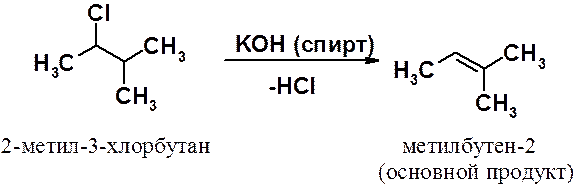
Как видно из схемы, возможно образование двух изомерных веществ - производных бутена-1 и бутена-2. Направление реакции предсказывает правило Зайцева: в ходе реакции элиминирования образуется алкен с наибольшим числом заместителей при двойной связи. Это правило совпадает с рядом устойчивости алкенов, которая убывает в ряду:
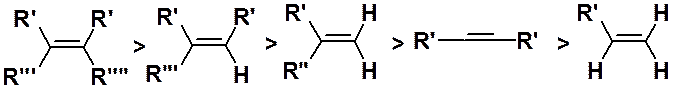
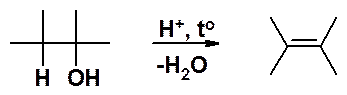
Реакция подобна дегидрогалогенированию, однако условия ее протекания другие. Реакцию проводят, нагревая спирт с разбавленной серной или фосфорной кислотами при температуре около 200оС, либо пропуская пары спирта при 400оС над оксидом алюминия (Al2O3). Направление отщепления воды от спирта то же самое, что и в случае отщепления галогеноводорода – атом водорода отщепляется от соседнего с функциональной группой наименее гидрогенизированного атома углерода. «Гидрогенизированный» - атом углерода, несущий водородные атомы. Водород отщепляется от того углерода, который связан с меньшим числом атомов водорода.
Если в органическом соединении два заместителя связаны с одним атомом углерода, такое расположение атомов или функциональных групп называется вицинальным (виц-). Если атомы или функциональные группы связаны с соседними углеродными атомами – геминальным (гем-).
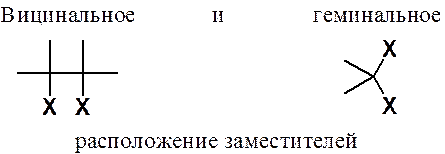
Вициальные дигалогенопроизводные под действием цинковой пыли легко отщепляют два атома галогена, превращаясь в алкен:
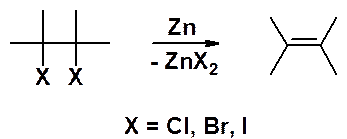
Источником алкенов могут быть и ацетиленовые углеводороды. Гидрирование алкинов в присутствии гетерогенного катализатора (Pt, Pd, Ni) сразу приводит к предельным углеводородам, поскольку промежуточно образующиеся алкены вступают в реакцию гидрирования легче, чем алкины.
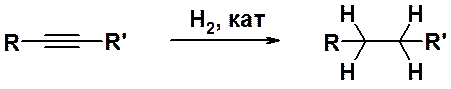
Для частичного гидрирования алкинов используют специально приготовленный катализатор, так называемый «отравленный катализатор» или «катализатор Линдлара» (палладий, содержащий свинец). Гидрирование на катализаторе Линдлара останавливается на стадии образования алкена и, следовательно, он не может быть использован для превращения алкенов в алканы. Следует отметить, что при таком восстановлении всегда образуются цис- или Z-изомеры.
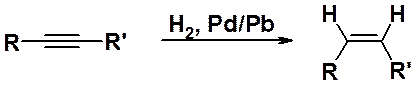
Похожий результат может быть получен при гидрировании алкинов металлическим натрием в жидком аммиаке. Принципиальное отличие этой реакции от каталитической в том, что образуются алкены транс- или Z-конфигурации.
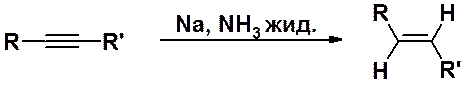
· Алкены. Химические свойства. Реакции электрофильного присоединения галогенов, галогеноводородов, кислот (H2SO4 и HClO), воды, гидроборирование. Правило Марковникова, его современная трактовка на основе представления о механизме реакции и относительной стабильности карбониевых ионов. Стереоспецифичность электрофильного присоединения.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.