В промышленности обычно получают вещество в больших количествах, стремясь к максимальной рентабельности. Часто можно использовать не чистое органическое соединение, а смесь. В ряде случаев экономически выгодно проводить разделение даже сложных смесей, в особенности, если одновременно удается выделить и другие полезные вещества. Известно много случаев, когда оказывается прибыльна разработка уникального метода синтеза и построение специального предприятия для выпуска высокорентабельного вещества.
В лаборатории обычно необходимо синтезировать небольшие количества вещества (граммы и доли грамма). В исследованиях химикам почти всегда необходимы индивидуальные вещества, а не смеси. В отличие от промышленности время имеет большую ценность, чем цена. Кроме того, лабораторные синтезы всегда гибкие, потому что исследователь не заинтересован в многократном повторении изученного процесса. Поэтому используются методы, позволяющие быстро, с высоким выходом получить целевой продукт с минимальным содержанием примесей.
Важно, что лабораторные (но не промышленные) методы, как правило, могут быть распространены на весь класс синтезируемых соединений.
В ходе изучения курса органической химии основное внимание направлено на лабораторные методы получения. При решении задач не следует использовать промышленные методы, даже в том случае, если они используются для получения именно того вещества, синтез которого необходимо спланировать. Например, если в ходе синтеза необходимо синтезировать этилен, его следует получать, используя общие методы синтеза алкенов, хотя это соединение в огромных количествах получают крекингом.
Алкены и алкины в присутствии гетерогенных катализаторов, таких как Pt, Pd, Ni, легко присоединяют один или два моль водорода при незначительном нагревании и невысоком давлении. При этом количественно образуются алканы с тем же углеродным скелетом.
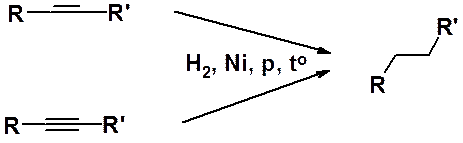
Галогенопроизводные насыщенных углеводородов могут быть восстановлены до алканов металлом в кислой среде:
![]()
Алканы могут быть получены гидролизом реактивов Гриньяра:
![]()
Приведенные выше методы позволяют синтезировать алканы, имеющие такой же углеродный скелет, как в исходной молекуле.
Для синтеза парафинов, строение углеродной цепи которых отличается от исходных веществ, известно несколько методов. Моногалогенопроизводные алканов при взаимодействии с металлическим натрием превращаются в предельные углеводороды по реакции Вюрца. В ходе реакции образуется углерод-углеродная связь между атомами углерода, связанными в исходном соединении с галогенами.
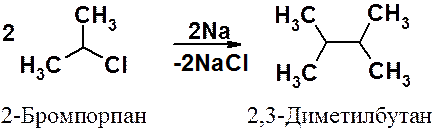
Реакция Вюрца может быть использована исключительно для синтеза симметричных алканов (R-R) с четным числом углеродных атомов. Во избежание образования смесей алканов в эту реакцию нужно вводить только одно галогенопроизводное.
Ограничения реакции Вюрца понятны из следующего примера.
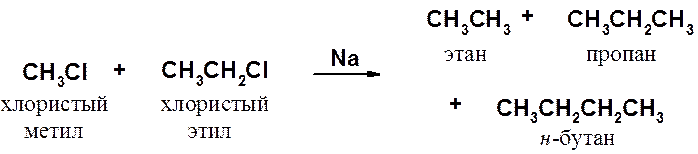
В реакции образуется смесь пропана, этана и н-бутана. Поскольку скорости реакций близки, невозможно предложить условия, в которых образование пропана будет преобладающим процессом. Следовательно, две трети исходных веществ будут израсходованы впустую. Кроме того, возникает сложная проблема разделения продуктов реакции.
При распространении реакции Вюрца на более сложные галогенопроизводные следует соблюдать осторожность. Щелочные металлы обладают очень высокой реакционной способностью. Если в молекуле, кроме атома галогена, есть функциональные группы, в большинстве случаев реакция натрия или калия с ними пойдет быстрее, чем с галогеном. Не имеет смысла даже пытаться проводить реакцию Вюрца, если в молекуле наряду с галогеном есть гидрокси- (OH), карбокси- (СOOH), сульфо- (SO3H) и многие другие группировки.
Одним из способов получения алканов является реакция декарбоксилирования (отщепления СО2) солей карбоновых кислот. В некоторых случаях этот процесс происходит очень легко уже при незначительном нагревании. Hасыщенные карбоновые кислоты алифатического ряда отщепляют карбоксильную группу только при прокаливании их солей со щелочью.

В результате декарбоксилирования образуется алкан, содержащий на один атом углерода меньше, чем было в исходной кислоте.
Если соль карбоновой кислоты алифатического ряда подвергнуть электролизу (анодный синтез Кольбе), то на аноде карбоксилат-анион отдает электроду один электрон, превращаясь в нестабильный радикал. Выброс СО2 приводит к алкильному радикалу. При рекомбинации двух алкильных радикалов образуется симметричный алкан с четным числом атомов углерода.
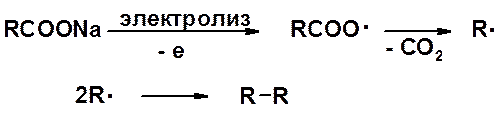
· Алкены. Гомологический ряд, номенклатура, виды изомерии. Геометрическая изомерия в ряду алкенов. Цис- и транс-изомеры, E,Z-номенклатура. Причины отсутствия свободного вращения относительно двойной связи. Физические свойства, закономерности их изменения в гомологическом ряду и спектральные характеристики алкенов.
· Методы получения: дегидрирование алканов, крекинг нефти, частичное гидрирование алкинов, дегалогенирование, дегидрогалогенирование галогеналканов и дегидратация спиртов (правило Зайцева).
Алкены - открытоцепные углеводороды, отвечающие общей формуле CnH2n.и содержащие в молекуле одну двойную связь (p-связь).
По сравнению с алканами соответствующие этиленовые углеводороды образуют большее число изомеров, что связано не только с различиями в углеродных скелетах, но также с расположением двойной связи и геометрией молекулы.
Рассмотрим изомерию алкенов с четырьмя атомами углерода. Кроме структурных изомеров есть изомеры положения двойной связи (бутен-1 и бутен-2). Бутен-2 может существовать в виде двух изомеров, отличающихся пространственным расположением заместителей относительно двойной связи. Поскольку свободное вращение относительно p-связи невозможно (барьер 60 ккал) и весь фрагмент молекулы лежит в одной плоскости, метильные группы могут располагаться либо с одной стороны от двойной связи, либо с противоположных сторон. В названии первых используют приставку цис- (с одной стороны – лат.), вторых – транс- (через – лат.). Такой вид пространственной изомерии называется геометрической.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.