ПРИМЕНЕНИЕ ПРАВИЛА ФАЗ К СИСТЕМЕ ЖЕЛЕЗО— УГЛЕРОД. ДИАГРАММА РООЗЕБУМА [1900 г.] КАК ПЕРВАЯ ДИАГРАММА ФАЗОВОГО РАВНОВЕСИЯ ЖЕЛЕЗО — УГЛЕРОД
В 1876—1878 гг. американский ученый Гиббс [101, 190] опубликовал свои труды, которые в конце 19 в. стали теоретической основой диаграмм состояний неоднородных систем, в том числе диаграмм состояний системы железо — углерод. В этих трудах Гиббс, исходя из общих положений термодинамики, установил основные законы, которым подчиняются условия равновесия в неоднородных системах, созданных одним или несколькими химическими веществами. Гиббс ввел в науку понятия «фаза» и «компонент» и, опираясь на чисто математический анализ термодинамических условий равновесия, ввел «правило фаз». Хотя правило фаз открыло в дальнейшем новый период развития физической химии, ученые сначала не обратили должного внимания на работы Гиббса. Это частично объясняется тем, что подход к проблеме в работах Гиббса казался слишком общим и абстрактным, а частично тем, что его труды были напечатаны в провинциальной академии Соединенных Штатов и попросту не дошли до заинтересованных ученых.
Только когда голландский ученый ван дер Ваалc обратил внимание своего ученика Роозебума на работы Гиббса, учение о фазах стало использоваться для исследований химических равновесий. Роозебум первый применил правило фаз для исследования и классификации неоднородных систем, причем сначала [159] предметом его исследований были системы Н2O—SO2, Н2О—Вr2, НВr—Н2O и NH4Br—NH3, затем [160, 164] водные растворы солей (двойные соли CaCl2). Кроме того, Роозебум [186] широко занимался процессами образования кристаллов твердых растворов, для которых использовал введенное ван Гоффом [170] название «смешанные кристаллы» (Mischkristalle). Наряду с Роозебумом исследованием равновесия в неоднородных системах занимались Стортенбекер [165] и Рике [175].
В результате многолетних исследований Роозебум [256, 257], опираясь на правило Гиббса, что состояние равновесия системы характеризуется минимальным для данных условий значением функции ζ (термодинамического потенциала), а также применяя графический метод ван Рийна ван Альксмаде [197], определил и классифицировал основные типы диаграммы состояний двухкомпонентных систем и возможные их различные комбинации, учитывая также при этом изменения в твердом состоянии. Для линии начала затвердевания Роозебум ввел [256] название ликвидус, а для линии конца затвердевания название солидус.
Отношения в сплавах железа с углеродом с точки зрения правила фаз впервые рассматривал Ле Шателье. В начале 1900 г. он опубликовал короткую статью [263], в которой на примере сплавов железа с углеродом анализировал условия сосуществования отдельных фаз этой системы от жидкого состояния вплоть до комнатной температуры. Исходя из предпосылки, что в двухкомпонентной системе в состоянии равновесия число фаз не может превышать числа компонентов, он утверждал, что если в сплаве Fe—С одновременно образуются железо, графит и карбид (Fe3C), то такая система является нестабильной; правило фаз требует, чтобы одна фаза исчезла, если должно быть достигнуто действительное равновесие. На практике это происходит (исчезает карбид) во время нагревания белого чугуна при производстве ковкого чугуна.
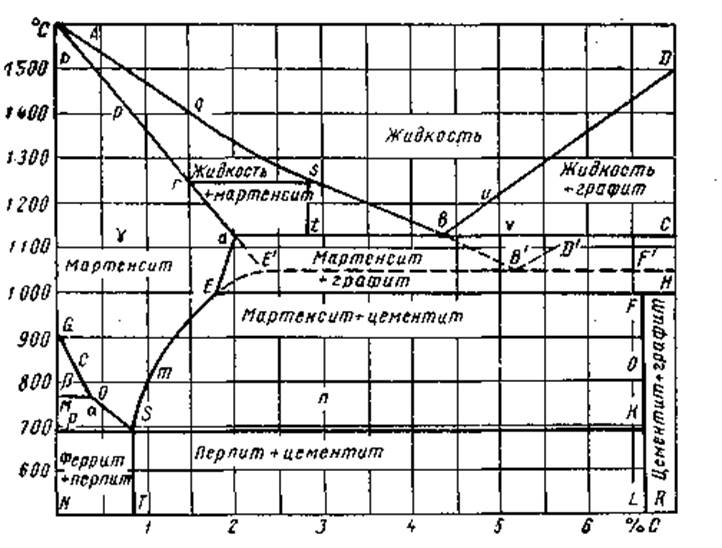 |
В том же 1900 г. вышла в свет работа Роозебума [270], в которой он рассматривает диаграмму систем Fe—С в соответствии с правилом фаз. Этот труд был результатом теоретических рассуждений, основу которых составляли данные экспериментальных исследований Робертс-Аустена. Роозебум подчеркнул, что целью его работы является дополнение и исправление взглядов Робертс-Аустеиа и выяснение сомнительных данных в системе Fe—С. Исходным пунктом, с одной стороны, было правило фаз, а с другой — знание процесса возникновения «смешанных кристаллов» (твердых растворов). В результате своих чисто теоретических рассуждений Роозебум дал диаграмму состояний Fe—С, представленную на рис. 16. На первый взгляд, эта диаграмма отличается от диаграммы Робертс-Аустена прежде всего тем, что вся ее поверхность разделена на замкнутые поля, которым соответствуют определенные фазы или комплексы фаз; все пограничные линии создают непрерывную сетку. Такое изображение является как раз результатом применения правила фаз для двойной системы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.