Лекция 1
3. ЗАДАЧА ТЕРМОДИНАМИКИ. ТЕРМОДИНАМИЧЕСКОЕ ОПИСАНИЕ СИСТЕМЫ. РАВНОВЕСНОЕ СОСТОЯНИЕ. КВАЗИСТАТИЧЕСКИЕ ПРОЦЕССЫ. ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ.
Задача термодинамики: изучить состояние системы и макропроцессы в ней, исходя из общих принципов (начал) без выяснения микроскопических механизмов изучаемых явлений.

 Равновесным называется состояние системы, при
котором макропараметры по всей системе имеют одно и то же значение, поэтому на
графиках зависимости макропараметров друг от друга равновесное состояние
изображается точкой (рис. 1).
Равновесным называется состояние системы, при
котором макропараметры по всей системе имеют одно и то же значение, поэтому на
графиках зависимости макропараметров друг от друга равновесное состояние
изображается точкой (рис. 1).
![]()
![]() (1)
(1)
![]()
Процессом в термодинамике называется переход системы из одного состояние в другое.

Квазистатический процесс (равновесный) представляется непрерывной последовательностью промежуточных равновесных состояний. Число параметров для описания то же, что и для равновесного состояния. Графическое изображение – кривая.

Неравновесный процесс – промежуточные состояния неравновесные. Для описания требуется бесконечное множество параметров. Графически не изображается.

Обратимым называется процесс, для которого возможен обратный переход из конечного состояния в начальное состояние через те же промежуточные состояния, что и в прямом процессе (рис. 2).
 Свойства обратимого процесса:
Свойства обратимого процесса:
1) нет изменений в окружающей среде, если в прямом процессе тепло поглощается, то в обратном выделяется, и наоборот;
2) внешнее давление равно внутреннему, работа внешних равна по модулю работе внутренних сил;
3) при бесконечно малом изменении параметров
направление процесса изменяется.

Изопроцессами называются процессы, при которых один из макропараметров остается постоянным.
![]()
Для идеального газа рассматривают равновесные обратимые процессы:

изотермический Т=const, р и V изменяются;
изобарный р=const, Т и V изменяются;
изохорный V=const, р и T изменяются;
адиабатический – процесс без теплообмена с окружающей средой, все макропараметры р, Т, и V изменяются.
 |
 Необратимым называется процесс, для
которого обратный переход через те же промежуточные состояния не возможен.
Неравновесный процесс всегда необратим, сопровождается изменениями в окружающей
среде.
Необратимым называется процесс, для
которого обратный переход через те же промежуточные состояния не возможен.
Неравновесный процесс всегда необратим, сопровождается изменениями в окружающей
среде.
ВНУТРЕННЯЯ ЭНЕРГИЯ. РАБОТА. ТЕПЛОТА. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ.

Внутренней энергией тела (вещества) называется его энергия в системе отсчета, связанной с центром масс или энергия всевозможных движений и взаимодействий частиц его составляющих.
![]()
U=U1+U2+U3 (2), где
U1 – кинетическая энергия движения молекул и атомов,
U2 – потенциальная энергия взаимодействия молекул и атомов,
![]() U3 – энергия внутриатомных и
внутриядерных движений и взаимодействий ( в молекулярной физике процессы с
изменением этого вида энергии не рассматриваются).
U3 – энергия внутриатомных и
внутриядерных движений и взаимодействий ( в молекулярной физике процессы с
изменением этого вида энергии не рассматриваются).
Для идеального газа из N частиц: ![]() (3),
потенциальная энергия взаимодействия молекул равна нулю.
(3),
потенциальная энергия взаимодействия молекул равна нулю.
![]() Поэтому внутренняя энергия идеального
газа
Поэтому внутренняя энергия идеального
газа ![]() (4),
(4),
т.е. является функцией абсолютной температуры U=U(T).
![]()
Внутренняя энергия является функцией состояния идеального газа.

Общий случай: U=U(T, V), т.е. внутренняя энергия является функцией состояния вещества.
При изменении объема (рис. 3) термодинамической системы может совершаться работа.
 Величина совершенной силой давления газа
Величина совершенной силой давления газа
![]() работы:
работы: ![]() (5), где dV – малое изменение
объема газа.
(5), где dV – малое изменение
объема газа.
 Работа, совершенная газом при изменении
объема от V1 до V2,
рассчитывается по формуле:
Работа, совершенная газом при изменении
объема от V1 до V2,
рассчитывается по формуле: 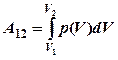 (6).
(6).
При расширении газа работа положительна, при сжатии – отрицательна.
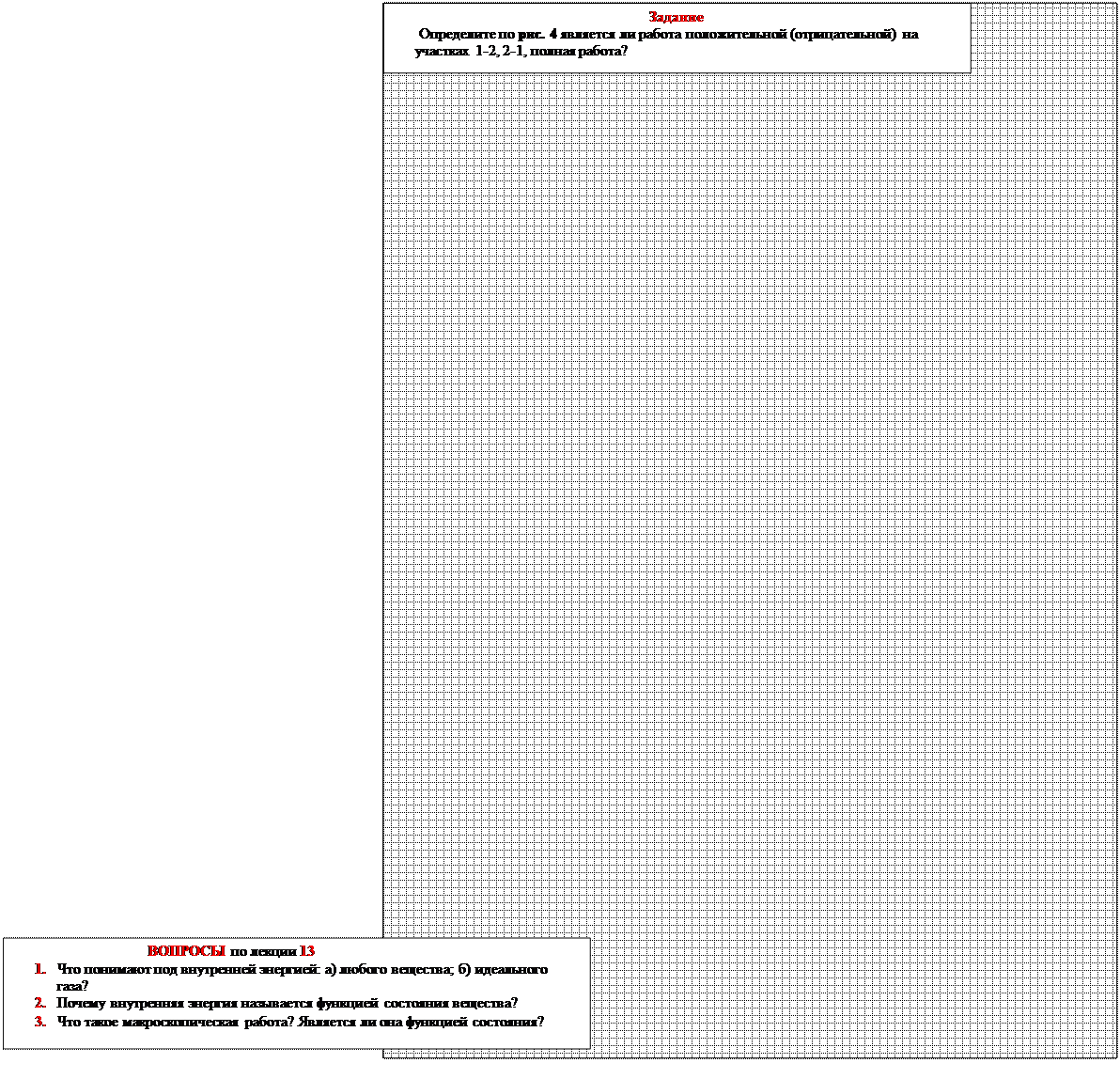
 На диаграмме (рис. 4)
рV величина работы численно равна площади под графиком процесса.
На диаграмме (рис. 4)
рV величина работы численно равна площади под графиком процесса.

Работа не является функцией состояния газа, т.к. величина работы зависит от вида совершенного процесса.
 |
 Количеством теплоты Q
называется количество энергии переданной системе (или полученной от нее) в
результате теплообмена (без совершения работы).
Количеством теплоты Q
называется количество энергии переданной системе (или полученной от нее) в
результате теплообмена (без совершения работы).
![]()
Теплообмен может происходить за счет различных процессов:
![]()
теплопроводность конвекция излучение
![]()
Количество теплоты не является функцией состояния.

![]() Первым началом
термодинамики называется закон сохранения энергии для тепловых процессов: количество
теплоты, полученное системой идет на изменение ее внутренней энергии и
совершение системой работы над внешними телами
Первым началом
термодинамики называется закон сохранения энергии для тепловых процессов: количество
теплоты, полученное системой идет на изменение ее внутренней энергии и
совершение системой работы над внешними телами ![]() (7).
(7).
Различное обозначение
малой величины: для работы ![]() и количества теплоты
и количества теплоты ![]() , а для внутренней энергии dU
принято для того, чтобы подчеркнуть, что первые две величины не являются
функциями состояния системы, а внутренняя энергия – функция состояния системы и
dU представляет собой полный дифференциал.
, а для внутренней энергии dU
принято для того, чтобы подчеркнуть, что первые две величины не являются
функциями состояния системы, а внутренняя энергия – функция состояния системы и
dU представляет собой полный дифференциал.
![]() Так как работа системы равна работе внешних
сил со знаком (-)
Так как работа системы равна работе внешних
сил со знаком (-) ![]() , то первое начало
, то первое начало
![]()
термодинамики может быть записано в виде ![]() (8)
(8)
![]()
Первое начало для процессов в идеальном газе :
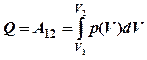 ;
;![]()
Энтальпией (тепловой функцией) называется функция
состояния ![]() (9).
(9).
При изобарическом процессе количество теплоты равно
приращению энтальпии ![]() (10).
(10).
 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.