Лекция 15. СИЛЫ МЕЖМОЛЕКУЛЯРНОГО ВЗАИМОДЕЙСТВИЯ. CИЛЫ ВАН-ДЕР-ВААЛЬСА. ПОТЕНЦИАЛЬНАЯ КРИВАЯ ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ.

Модель идеального газа применима для реальных газов в том случае, когда расстояние между молекулами много больше размеров молекул.
Для небольших молекул воздуха
(О2, N2, СО2, Н2О и т.д.),
которым дышит человек при нормальном атмосферном давлении среднее расстояние
между молекулами примерно в 30 раз больше среднего диаметра молекул ![]() .
.

С точки зрения классической физики: отрицательные электроны удерживаются в атоме за счет сил притяжения положительного ядра. В целом атом нейтрален.
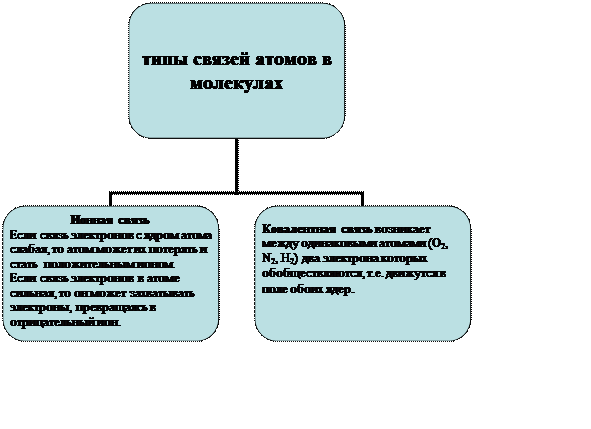

Ионная связь в молекуле обеспечивается электрическим взаимодействием положительного и отрицательного ионов, образующих молекулу.

Силами Ван-дер-Ваальса называются силы притяжения, действующие между молекулами на расстояниях сравнимых с размерами молекул.
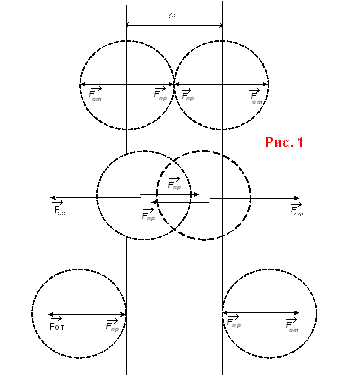
Эксперименты подтверждают, что силы взаимодействия между молекулами могут быть как силами отталкивания, так и силами притяжения (рис. 1).
 |

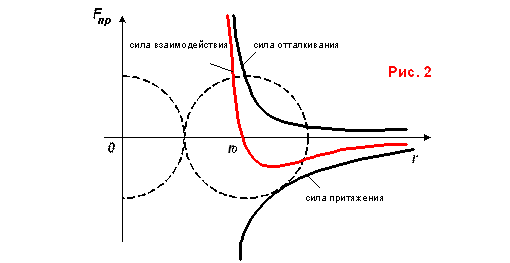 Если связать начало системы
отсчета с центром одной молекулы (рис. 2),зависимость потенциальной энергии
взаимодействия от расстояния между центрами молекул имеет сложный характер, а величина
потенциальной энергии взаимодействия молекул может быть рассчитана по формуле:
Если связать начало системы
отсчета с центром одной молекулы (рис. 2),зависимость потенциальной энергии
взаимодействия от расстояния между центрами молекул имеет сложный характер, а величина
потенциальной энергии взаимодействия молекул может быть рассчитана по формуле:
![]() (1),
где показатели степени зависят от конкретных
свойств молекул.
(1),
где показатели степени зависят от конкретных
свойств молекул.
![]() Для многих молекул хорошее приближение дают
n=12, m=6 и зависимость
потенциальной энергии:
Для многих молекул хорошее приближение дают
n=12, m=6 и зависимость
потенциальной энергии: ![]() (2).
(2).
![]()

![]()
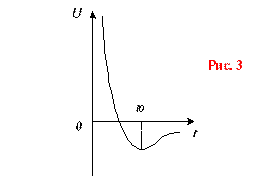
![]() (3)
(3)
![]()
![]()
 Из
механики
Из
механики ![]()
![]() (4)
(4)
При расстоянии (рис. 3)
r=r0 ![]() ,
а
,
а ![]() .
.
· Силы межмолекулярного взаимодействия обеспечивают переход реальных газов, при определенных условиях, в жидкое состояние, т.е. процесс конденсации.
· Для реальных газов уравнение Клапейрона-Менделеева не выполняется.
 |
ГАЗ ВАН-ДЕР-ВААЛЬСА. УРАВНЕНИЕ СОСТОЯНИЯ. КРИТИЧЕСКОЕ СОСТОЯНИЕ. ВНУТРЕННЯЯ ЭНЕРГИЯ ВАН-ДЕР-ВААЛЬСА.
I.Экспериментальное исследование реальных газов.
 При изотермическом сжатии, например, аммиака при
температуре Т1 (опыт Ван-Марума) (рис.
4) зависимость давления от объема не подчиняется закону
При изотермическом сжатии, например, аммиака при
температуре Т1 (опыт Ван-Марума) (рис.
4) зависимость давления от объема не подчиняется закону ![]() или
или 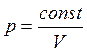 .
.

Насыщенным называется газ, находящийся в состоянии динамического равновесия со своей жидкостью.

Изотермами Ван-дер-Ваальса (рис. 5) называется набор экспериментальных зависимостей давления от объема для реальных газов.
 В диапазоне
В диапазоне ![]() при
при ![]() два фазовых состояния вещества: жидкость
и насыщенный пар.
два фазовых состояния вещества: жидкость
и насыщенный пар.
![]()
К – критическая точка;
V2 – объем насыщенного пара;
![]() - ненасыщенный пар;
- ненасыщенный пар;
V1 – объем жидкости;
![]() - только газ при любом давлении.
- только газ при любом давлении.

Критическим называется такое состоянием вещества, при котором физические свойства различных фазовых состояний одинаковы.

Критическими называются соответствующие этому состоянию параметры: критическая температура Тк, давление рк, объем Vk.

Вещество в газовом состоянии при температуре выше критической T>Tk невозможно перевести в жидкое состояние ни при каком давлении.
 |
II. Уравнение Ван-дер-Ваальса.
Уравнение Клапейрона – Менделеева получено для идеального газа, т.е. в случае, когда силы взаимодействия молекул не учитываются.
Как учесть силы отталкивания и притяжения между молекулами?
1) Действие сил отталкивания приводит к тому, что в объем, занимаемый одной молекулой, не может проникнуть другая (рис. 6).
![]()
 Объем
недоступный для движения:
Объем
недоступный для движения: ![]() (5), где d – средний диаметр
молекулы, V0 – занимаемый ею объем.
(5), где d – средний диаметр
молекулы, V0 – занимаемый ею объем.
Для одного моля идеального газа:
![]() а) недоступный
для движения молекул объем b=4V0NA (6),
а) недоступный
для движения молекул объем b=4V0NA (6),
![]()
б) объем, в
котором молекулы могут двигаться ![]() (7), где
(7), где ![]() - объем,
занимаемый молем реального газа.
- объем,
занимаемый молем реального газа.
2)
![]()
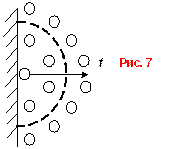 Так как в реальном газе
существуют силы притяжения между молекулами, то молекулы возле стенки
притягиваются внутренними молекулами. Поэтому возникает дополнительное
эффективное давление
Так как в реальном газе
существуют силы притяжения между молекулами, то молекулы возле стенки
притягиваются внутренними молекулами. Поэтому возникает дополнительное
эффективное давление ![]() , пропорциональное числу
молекул, приходящейся на единицу площади, а также результирующей силе
притяжения другими молекулами (рис. 7)
, пропорциональное числу
молекул, приходящейся на единицу площади, а также результирующей силе
притяжения другими молекулами (рис. 7)![]() (также на единицу площади)
(также на единицу площади) ![]() .
.

![]()
![]()
![]() (8)
. Концентрация молекул для одного моля газа
(8)
. Концентрация молекул для одного моля газа 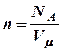 (9).
(9).
Поэтому дополнительное давление 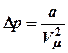 (10),
где а =const,
зависящая от природы молекул и количества газа.
(10),
где а =const,
зависящая от природы молекул и количества газа.
Уравнением Ван-дер-Ваальса называется уравнение состояния реального газа:
 для одного моля газа:
для одного моля газа: 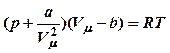 (11),
(11),
 для
для ![]() молей
газа:
молей
газа: 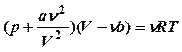 (12).
(12).
Соответствует ли это уравнение реальным изотермам Ван-дер-Ваальса?

Преобразуем уравнение для одного моля: ![]() (13).
(13).
Полученное уравнение третьей степени, т.е. имеет три значения объема моля для каждого значения давления, и соответственно дает набор теоретических изотерм Ван-дер-Ваальса.
 |

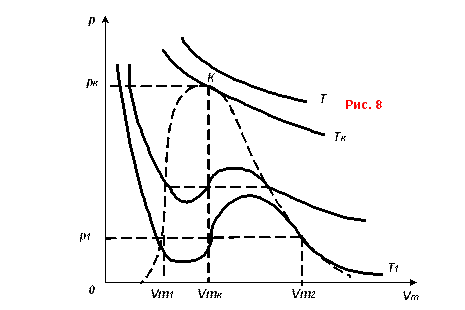
![]()
![]()
теория и эксперимент (рис. 8 и рис. 9)
Сравнение с экспериментальными показывает:
·
![]() на участках АB и EL
теория и эксперимент согласуются;
на участках АB и EL
теория и эксперимент согласуются;
· на участке СD состояние вещества неустойчиво и не реализуется, т.к. уменьшению объема соответствует уменьшение давления;
· участок СB соответствует пересыщенному пару, т.е. по физическим свойствам это должна быть жидкость, но вещество остается в газообразном состоянии;
· участок ED соответствует перегретой жидкости, которая по своим параметрам должна быть газом, но остается в фазе жидкости.

Метастабильными называются состояния, которые не являются абсолютно устойчивыми, и при незначительном внешнем воздействии переходят в ближайшее устойчивое состояние.
Пересыщенный пар и перегретая жидкость являются метастабильными состояниями вещества.
Уравнение Ван-дер-Ваальса позволяет определить критические параметры.
![]() При Т=Тк
При Т=Тк ![]() (14)
и уравнение третьей степени можно записать:
(14)
и уравнение третьей степени можно записать:
![]()
![]() (15).
(15).
Из сравнения коэффициентов при одинаковых степенях молярного
объема ![]()
![]()
![]()
![]() критические
параметры:
критические
параметры: ![]() (16),
(16),
![]() (17),
(17),
![]() (18).
(18).
Внутренняя энергия газа Ван-дер-Ваальса определяется энергией хаотического движения молекул и потенциальной энергией взаимодействия молекул:
![]()
![]() (19),
где
(19),
где ![]() изохорная молярная теплоемкость.
изохорная молярная теплоемкость.

![]() ,
, 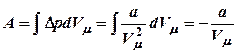 (20).
(20).
 Внутренняя энергия одного моля газа
Ван-дер-Ваальса
Внутренняя энергия одного моля газа
Ван-дер-Ваальса 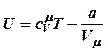 (21).
(21).
 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.