


Задача 1. По табличным значениям энергии связей в молекулах водорода и хлора, потенциалу ионизации водорода (1312,52 кДж/моль) и сродству хлора к электрону (363,66 кДж/моль) вычислить стандартную энтальпию образования газообразных ионов водорода и хлора. Энергии диссоциации молекул H2 и Cl2 равны 431,63 и 238,26 кДж/моль соответственно.
Решение.
Стандартная энтальпия образования газообразных ионов водорода и хлора ΔfH0(H+(г.)) и ΔfH0(Cl–(г.)) равна изменению энтальпии в процессах образования 1 моль ионов H+(г.) и Cl–(г.) из простых веществ: ½H2 (г.) = H+(г.) и ½Cl2 (г.) = Cl– (г.).
Представим, что эти процессы проводят в две стадии: 1) сначала разрушают связи между атомами в молекулах водорода и хлора, 2) затем от каждого атома водорода отнимают электрон, и к каждому атому хлора присоединяют один электрон.
|
|
Для получения 1 моль ионов водорода нужно разрушить 0,5 моль связей H–H (атомизировать 0,5 моль H2) и ионизировать 1 моль атомов водорода. Разрушение связи и отрыв электрона от атома требуют затрат энергии (ΔH > 0). |
В соответствии с приведенной выше схемой, основываясь на законе Гесса, вычислим энтальпию образования ионов водорода.
ΔfH0(H+(г.)) = 0,5 Eсв. + Δион.H0(H (г.)) = 0,5×431,63 + 1312,52 = 1528,34 кДж/моль
|
|
Для получения 1 моль хлорид-ионов нужно разрушить 0,5 моль связей Cl–Cl (атомизировать 0,5 моль Cl2) и присоединить 1 моль электронов к 1 моль атомов хлора. При присоединении одного электрона к атому хлора энергия выделяется (ΔH < 0). |
В соответствии с приведенной выше схемой, основываясь на законе Гесса, вычислим энтальпию образования хлорид-ионов.
ΔfH0(Cl–(г.)) = 0,5 Eсв. + Δср. к эл.H0(Cl (г.)) = 0,5×238,26 + (–363,66) = –244,53 кДж/моль.
Ответ: ΔfH0(H+(г.)) = 1528,34 кДж/моль, ΔfH0(Cl–(г.)) = –244,53 кДж/моль.
Задача 2. Теплота атомизации и первый потенциал ионизации серебра 285,95 и 727,32 кДж/моль. Энергия связи в молекуле брома 189,9 кДж/моль, теплота испарения 30,51 кДж/моль. Вычислить энергию кристаллической решётки бромида серебра, если сродство к электрону атома брома 347 кДж/моль, стандартная энтальпия образования AgBr равна –99,07 кДж/моль.
Решение.
Представим, что образование бромида серебра из простых веществ (Ag (т.) + ½Br2 (ж.) = AgBr (т.)) протекает в несколько стадий. Сначала проводят атомизацию серебра, т.е. разрушают связи между атомами серебра (Ag (т.) → Ag (г.)), затем ионизацию серебра (Ag (г.) → Ag+ (г.)), испарение и атомизацию брома (½Br2 (ж.) → ½Br2 (г.) и ½Br2 (г.) → Br (г.)), присоединение 1 моль электронов к 1 моль атомов брома (Br (г.) → Br– (г.)) и взаимодействие газообразных ионов брома и водорода с образованием бромида серебра (Ag+ (г.) + Br– (г.) = AgBr (т.)).
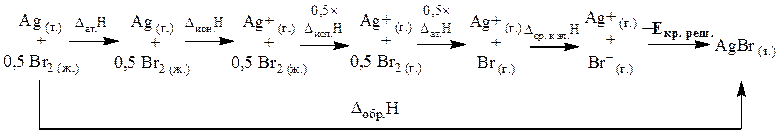
В соответствии с приведенной выше схемой, основываясь на законе Гесса, представим энтальпию образования бромида серебра в виде суммы энтальпий отдельных стадий:
ΔfH0(AgBr(т.)) = Δат.H0(Ag (т.)) + Δион.H0(Ag (г.)) + 0,5×Δисп.H0(Br2 (ж.)) + 0,5×Δат.H0(Br2 (г.)) + Δср. к эл.H0(Br (г.)) + (–Eкр. реш.(AgBr(т.))).
Выразим энергию кристаллической решётки бромида серебра:
Eкр. реш.(AgBr(т.)) = Δат.H0(Ag (т.)) + Δион.H0(Ag (г.)) + 0,5×Δисп.H0(Br2 (ж.)) + 0,5×Δат.H0(Br2 (г.)) + Δср. к эл.H0(Br (г.)) – ΔfH0(AgBr(т.)) = 285,95 + 727,32 + 0,5×30,51 + 0,5×189,9 + (–347) – (–99,07) = 875,55 кДж/моль.
Ответ: Eкр. реш.(AgBr(т.)) = 875,55 кДж/моль.
Задача 3. По энергиям связей в молекулах азота и водорода (940,5 и 431,63 кДж/моль) и стандартной энтальпии образования аммиака (–45,98 кДж/моль) рассчитайте среднюю энергию связи в молекуле аммиака.
Решение.
Представим, что образование аммиака из простых веществ (0,5 N2 (г.) + 1,5 H2 (г.) = NH3 (г.)) протекает в две стадии: сначала разрушают все связи в молекулах азота и водорода, а затем из атомов азота и водорода образуются молекулы аммиака. В первом процессе нужно затратить энергию, чтобы разрушить 0,5 моль связей N≡N и 1,5 моль связей H–H, а во втором выделяется энергия за счёт образования 3 моль связей N–H. Суммарное изменение энтальпии в результате протекания обоих процессов равно энтальпии образования 1 моль аммиака из простых веществ.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.