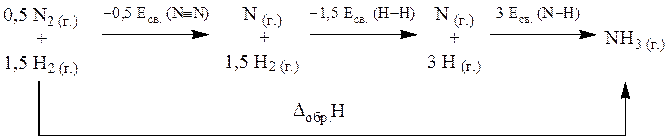
ΔfH0(NH3 (г.)) = 0,5×Eсв. (N≡N) + 1,5×Eсв. (H–H) + (–3×Eсв. (N–H)) =>
Eсв. (N–H) = (0,5×Eсв. (N≡N) + 1,5×Eсв. (H–H) – ΔfH0(NH3 (г.)))/3 = (0,5×940,5 + 1,5×431,46 – (–45,98))/3 = 387,89 кДж/моль.
Ответ: ΔfH0(NH3 (г.)) = 387,89 кДж/моль.
Задача 4. По стандартной энтальпии образования метана (–74,78 кДж/моль), стандартной сублимации графита (714,78 кДж/моль) и энергии связи H–H (431,63 кДж/моль) вычислите среднюю энергию связи C–H.
Решение.

Eсв. (C–H) = (Δсубл.H(C(гр.)) + 2×Eсв. (H–H) – ΔfH0(CH4 (г.)))/4 = (714,78 + 2×431,46 – (–74,78))/3 = 412,21 кДж/моль.
Ответ: ΔfH0(CH4 (г.)) = 412,21 кДж/моль.
Задача 5. Возможно ли протекание следующих реакций при а) комнатной температуре; б) высоких температурах:
1) O2 (г.) + 2H2O (ж.) = 2H2O2 (ж.) ΔH0298 = 197,28 кДж
2) 2NO (г.) + O2 (г.) = 2NO2 (г.) ΔH0298 = –601,92 кДж
3) CaCO3 (т.) = CaO (т.) + CO2 (г.) ΔH0298 = 117,65 кДж
Решение.
В реакции №1 ΔH0298 > 0, а ΔS0298 < 0, так как число моль газов в реакции уменьшается. ΔG0T = ΔH0298 – T· ΔS0298 > 0 при любой температуре. Следовательно, эта реакция ни при какой температуре не может идти самопроизвольно. Для неё нельзя подобрать катализатор.
В реакции №2 ΔS0298 < 0, так как число моль газов в реакции уменьшается. ΔG0T = ΔH0298 + (–T·ΔS0298). Первое слагаемое меньше, а второе – больше нуля. Знак ΔG0T определяется знаком того слагаемого, которое больше по модулю. При стандартных условиях ΔG0298 < 0, так как энтальпия реакции сильно отрицательная величина |ΔH0298| > |–298·ΔS0298|. Реакция идёт самопроизвольно, для неё можно подобрать катализатор. При повышении температуры энергия Гиббса реакции становится менее отрицательной величиной, а равновесие смещается в сторону исходных веществ. Если T > (ΔH0298/ΔS0298), то ΔG0T > 0. При высоких температурах реакция идёт самопроизвольно в обратном направлении, и никакой катализатор не может сместить равновесие в сторону образования N2O3.
В реакции №3 ΔS0298 > 0, так как число моль газов в реакции увеличивается. ΔG0T = ΔH0298 + (–T·ΔS0298). Первое слагаемое больше, а второе – меньше нуля. Знак ΔG0T определяется знаком того слагаемого, которое больше по модулю. При стандартных условиях ΔG0298 > 0, так как энтальпия реакции сильно положительная величина |ΔH0298| > |–298·ΔS0298|. Реакция идёт самопроизвольно в обратном направлении, при стандартных условиях для неё нельзя подобрать катализатор. При повышении температуры энергия Гиббса реакции уменьшается, а равновесие смещается в сторону продуктов. Если T > (ΔH0298/ΔS0298), то ΔG0T < 0. При высоких температурах реакция идёт самопроизвольно в прямом направлении, для неё можно подобрать катализатор.
Катализатор не смещает равновесие, так как он одинаково ускоряет как прямую, так и обратную реакцию. Роль катализатора заключается в более быстром достижении состояния равновесия.
Задача №6. Вычислить приблизительно температуру, при которой константа равновесия реакции CO (г.) + H2O (г.) = CO2 (г.) + H2 (г.) равна единице.
|
CO (г.) |
H2O (г.) |
CO2 (г.) |
H2 (г.) |
|
|
ΔfH0298 |
–110,44 |
–241,60 |
–393,34 |
0 |
|
S0298 |
197,71 |
188,64 |
213,6 |
130,46 |
Решение.
ΔrG0T = –RT·lnK = –RT·lnK = 0.
Подставив полученное значение энергии Гиббса в формулу:
ΔrG0T = ΔrH0298 – T· ΔrS0298, получим 0 = ΔrH0298 – T·ΔrS0298.
Из последней формулы выразим температуру: T = ΔrH0298/ΔrS0298.
Воспользуемся следствием из закона Гесса, чтобы найти ΔrH0298 и ΔrS0298.
ΔrH0298 = Σnпрод.·ΔfH0298прод. – Σnисх.·ΔfH0298исх. = –393,34 – (–110,44 + (–241,60)) = –41,3 кДж/моль = –41300 Дж/моль.
ΔrS0298 = Σnпрод.·S0298прод. – Σnисх.·S0298исх. = –42,29 Дж/моль.
Найдём температуру.
T = ΔrH0298/ΔrS0298 = –41300/–42,29 = 977 К.
Ответ: T = 977 К.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.