






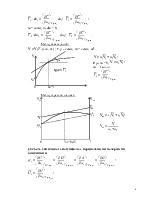





Термодинамика растворов
§1. Основные термодинамические свойства закрытых систем.
Закрытой называется система, не обменивающаяся веществом с окружающей средой.
Поэтому термодинамические свойства представлены: T, p, V, U,H, S, A, G – не зависят от количества вещества компонентов системы
U=U(T,V), U=U(S,V)
H=H(T,p), H=H(S,p)
S=S(T,V), S=S(T,p)
A=A(T,V)
G=G(T,p)
Процессы, протекающие в закрытых системах описываются уравнениями термодинамики.
Уравнение первого закона термодинамики:
dU=dQ-pdV; dH=dQ+Vdp
Уравнение второго закона термодинамики:

Объединенное уравнение:
TdS![]() dU+pdV
dU+pdV
TdS![]() dH-Vdp
dH-Vdp
Фундаментальные уравнения термодинамики:
1)
dU![]() TdS-pdV
TdS-pdV
2)
dH![]() TdS+Vdp
TdS+Vdp
3)
dA![]() -SdT-pdV
-SdT-pdV
4)
dG![]() -SdT+Vdp
-SdT+Vdp
Из фундаментальных уравнений выводятся критерии:
(dU)S,V![]() 0
0
(dH)S,p![]() 0
0
(dA)T,V![]() 0
0
(dG)T,p![]() 0
0
§2. Термодинамические свойства открытых систем.
Система называется открытой, если она обменивается веществом с окружающей среды.
Наиболее характерный вид открытых систем – растворы.
Растворы могут быть твердыми, жидкими и газообразными.
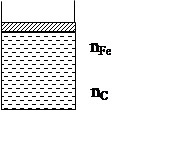
Раствором называется однородная смесь переменного состава, состоящая из двух и более компонентов. Растворы обязательно гомогенные образования.
Обозначим количество вещества в растворе через n.
n1, n2,…,ni,…,nk – раствор, состоящий из k компонентов.
В металлургии используются растворы:
Fe-C, Fe-Ni, Fe-Mn, Fe-Cr – двойные или бинарные растворы.
|
U=U(T, V, n1, n2,…nk)
H=H(T, p, n1, n2,…nk)
S=S(T, p, n1, n2,…nk)
A=A(T, V, n1, n2,…nk)
G=G(T, p, n1, n2,…nk)
Химический потенциал.
Если к гомогенной системе из k компонентов добавляется бесконечно малое количество вещества одного компонента и при этом система остается гомогенной, а ее энтропия и объем постоянными, то увеличение внутренней энергии системы деленное на добавленное количество вещества компонента называется химическим потенциалом компонента в гомогенной системе.
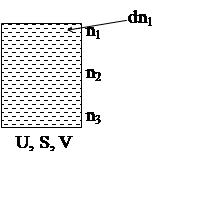 В систему вводим бесконечно малое dn1, то
В систему вводим бесконечно малое dn1, то
U®U+dU
S=const
V=const
n2=const
n3=const
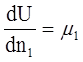 - химический потенциал первого компонента в
гомогенной системе или растворе.
- химический потенциал первого компонента в
гомогенной системе или растворе.
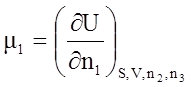
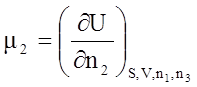
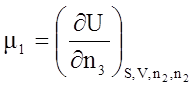
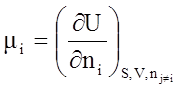
По своему физическому содержанию химический потенциал является мерой химической активности компонента в системе.
Химической активностью называется способность вещества вступать в физические и химические взаимодействия с другими веществами в системе.
Чем в большем числе взаимодействий может участвовать данный компонент, тем выше его химическая активность и тем больше химический потенциал этого компонента.
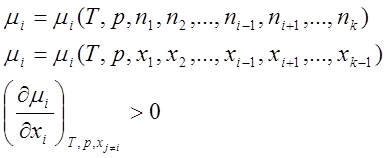
Чем выше молярная доля компонента в растворе, тем больше химический потенциал этого компонента, следовательно тем больше химическая активность компонента.
![]() - химический потенциал чистого компонента.
- химический потенциал чистого компонента.
Фундаментальные уравнения термодинамики открытых систем.
![]()
 n1®n1+dn1
n1®n1+dn1
|
U=U(S,V,n1,n2)
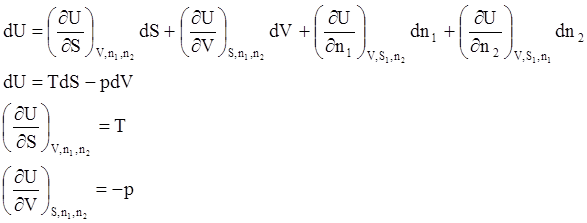
dU=TdS-pdV+m1dn1+m2dn2 (Если m1=m2, то dU=TdS-pdV)
Фундаментальные уравнения:
1)
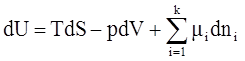
2)
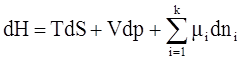
3)
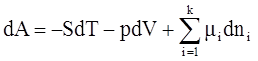
4)
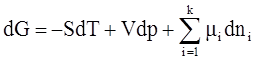
Условие самопроизвольного протекания и равновесия процессов в открытых системах.
Найдем изменение термодинамической величины при постоянных:
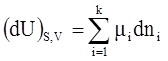
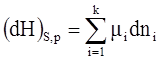
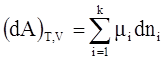
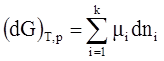
В закрытых системах было найдено, что:
![]()
В открытых системах:
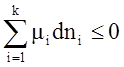
Условие самопроизвольного протекания процессов в открытых системах состоит в том, что сумма произведений химических потенциалов компонентов на бесконечно малое изменение их количеств в системе обязательно уменьшится. Условием равновесия является равенство аналогичной суммы нулю.
Примеры:
1) условие самопроизвольного перехода компонента из одной области в другую область (условие диффузии).
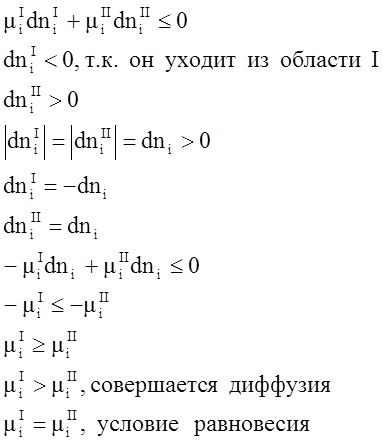
Кроме
гомогенных систем в этой же самой форме справедливы условия самопроизвольного
перехода компонента из одной фазы в другую: ![]()
и равновесия фаз в гетерогенной системе:
![]() .
.
Самопроизвольное протекание и равновесие химических реакций.
![]() ;
;
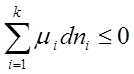 ;
;
![]() ;
;
![]() ;
;
![]()
![]() ,
, ![]() ,
, ![]() ,
, ![]() ;
;
![]() ;
;
![]() ;
;
![]() .
.
Самопроизвольное течение химической реакции:
![]() ;
;
Следовательно, реакция будет протекать в заданном направлении в том случае, если сумма химических потенциалов исходных веществ больше суммы химических потенциалов продуктов реакции.
Равновесие реакции:
![]() .
.
В состоянии равновесия химической реакции сумма химических потенциалов исходных веществ равна сумме химических потенциалов продуктов реакции.
Оба эти условия без изменений применимы к гетерогенным реакциям.
Примеры:
2CO(г) + О2(г) = 2СО2(г) – гомогенная реакция;
![]() -
условие самопроизвольного протекания реакции (горения СО);
-
условие самопроизвольного протекания реакции (горения СО);
![]() -
условие равновесия реакции.
-
условие равновесия реакции.
3Fe(к) + 2О2(г)= Fe3O4(к) – гетерогенная реакция;
![]() -
условие самопроизвольного протекания реакции;
-
условие самопроизвольного протекания реакции;
![]() -
условие равновесия реакции.
-
условие равновесия реакции.
§3.Парциальные молярные свойства компонентов в растворе.
Будем рассматривать растворы в изобаро-изотермических системах (т.е. Т,р=const). В этом случае U, H, S, A ,G ,V º j (Т, р, n1, n2,…,nk).
 |
Часть термодинамического свойства раствора, приходящегося на 1 моль компонента называется молярной величиной компонетна в растворе.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.