Министерство образования Российской Федерации
САНКТ–ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ ГОРНЫЙ ИНСТИТУТ
(технический университет)
Кафедра общей и физической химии
Отчет
по лабораторной работе:
«Химическая кинетика»
Выполнили: студентки группы МЦ-02
Мельник К.И. Ларионов С.С.
Проверил: Дубровская Н.Я.
Санкт-Петербург
2004 год
Цель работы: определить константу скорости реакции 2-го порядка окисления йодида персульфатом аммония.
Общие сведения: Скорость реакции по данному компоненту – это изменение числа молей этого компонента в единицу времени, отнесенное для гомогенных реакций к единице объема.
Скорость реакции зависит от исходной концентрации реагентов, температуры, наличия катализаторов и т.д.
Реакция окисления йодида калия персульфатом аммония может быть записана в виде :
![]()
или в ионной форме
![]()
Несмотря на наличие различных стехиометрических коэффициентов, реакция, как доказано, протекает по 1-му порядку для каждого из компонентов, т.е по суммарному 2-му порядку:
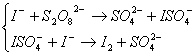
Измерение скорости реакции основано на добавлении в реакцию тиосульфата натрия, который реагирует с образовавшимся йодом, не давая тому окрашивать крахмал в синий цвет; окраска появляется только при израсходовании тиосульфата.
![]()
Расчетные формулы:
![]()
, где ![]() - время реакции
- время реакции
![]() -
число молей выделившегося йода.
-
число молей выделившегося йода.
![]()
|
№ опыта |
KI , мл (0,2н) |
Na2S2O3, мл (0,02н) |
H2O, мл |
Крахмал, мл (1%) |
Na2S2O8, мл (0,2н) |
∑V, мл |
|
1 |
14 |
2 |
10 |
5 |
14 |
45 |
|
2 |
14 |
4 |
8 |
5 |
14 |
45 |
|
3 |
14 |
6 |
6 |
5 |
14 |
45 |
|
4 |
14 |
8 |
4 |
5 |
14 |
45 |
|
5 |
14 |
10 |
2 |
5 |
14 |
45 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.