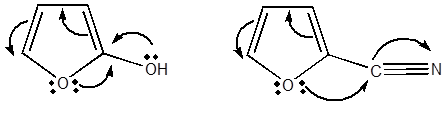1 АНАЛИТИЧЕСКИЙ ОБЗОР
1.1
Фурановые соединения
За последние годы химия фурана развивалась весьма успешно и фурановые
соединения стали играть заметную практическую роль и сами по себе, и как
полупродукты в органическом синтезе, в том числе при получении высоко полимеров
и синтетических волокон.
Способность простейших фурановых соединений образовывать смолы была впервые
замечена еще в позапрошлом столетии. Так Стенхауз в 1840 г. констатировал, что
фурфурол может образовывать смолообразные продукты; однако в то время это
наблюдение представляло только теоретический интерес.
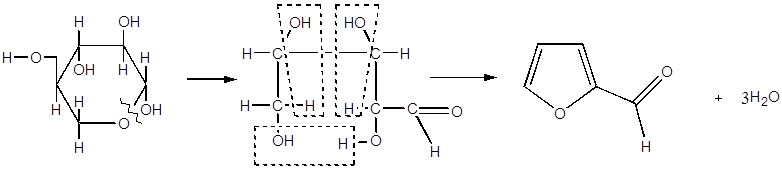
1.1.1 Сырье для получения фурановых производных
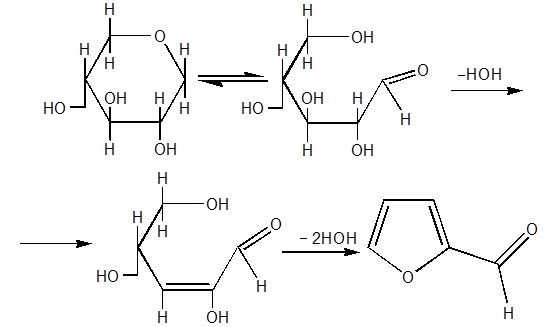
Исходным сырьем в производстве большинства фурановых мономерных и
полимерных продуктов является фурфурол. Получение которого осуществляется из
пентозансодержащих материалов, являющихся малоценными отходами
сельскохозяйственного производства, лесой и лесохимической промышленности.
Превращение пентозанов в фурфурол включает ряд последовательных реакций,
сопровождающихся разрывом связей между компонентами клеточной сетки, гидролизом
пентозанов с образованием пентоз и их последующей дегидратацией до фурфурола [1].
↓
1.1.2 Свойства фурановых соединений
В фурановом кольце не поделенная пара электронов гетероатома (кислорода)
принимает участие во взаимодействии с π – электронами углеродных атомов цикла, образуя, как в бензоле,
общее электронное облако
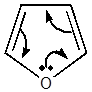
В результате сопряжения кольцо становится плоским, простые связи
укорачиваются. Дипольный момент фурана, сравнительно с тетрагидрофураном,
понижается. Однако в отличии от бензола, в молекуле фурана 6π – электронов
приходится на 5σ – связей. Обобществление π – электронов в случае фурана менее
полное; нет характерной, как для бензола, полной тождественности связей, что
также относится и к их прочности. Таким образом сочетание в фурановом ядре двух
сопряженных двойных связей и простой эфирной группы приводит к возникновению
специфического комплекса свойств, присущих соединениям фуранового ряда. Следует
отметить, что эти специфические особенности фурановых веществ обуславливаются
самим фурановым ядром, но не замещающими функциональными группами [2].
К специфическим реакциям фурановых соединений следует отнести:
-
реакции двойных связей цикла;
-
реакции замещения при углеродных атомах цикла;
-
реакции эфирной группы гетероатома кислорода;
-
реакции раскрытия цикла.
Известны
многочисленные реакции, обусловленные присутствием двойных связей в фурановом
цикле. Так, фуран, его алкил- и арилгомологи и другие производные с
заместителями, не содержащими непосредственном сопряжении с циклом кратных
связей (С = С, С = О, - NO и т. д.), образуют с большой легкостью
нормальные аддукты с малеиновым ангидридом, малеиновой кислотой,
ацетилендикарбоновой кислоты и ее эфирами.
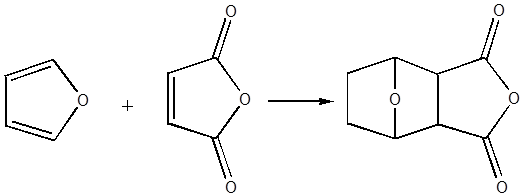
Аддукты фуранов, образующиеся при диеновом синтезе,
в большинстве своем отличаются малой термостойкостью, и имеют склонность к
диссоциации на исходные компоненты.
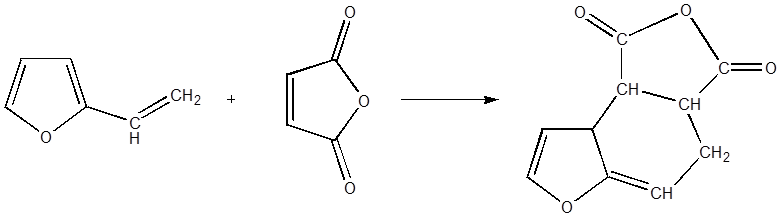
Заместители с сопряженной двойной связью в боковой цепи перемещают
направление диеновой реакции. Это видно на примере винилфурана, который
вступает в реакцию диенового синтеза, причем реагирует диеновая система,
включающая двойную связь боковой цепи и сопряженную с ней двойную связь цикла
Известно значительное число реакций прямого замещения в ядре фурана.
Так фуран и фурановые производные
вступают в обычные для ароматических соединений реакции электрофильного
замещения, причем легче бензола.
Замещение
во всех случаях происходит в первую очередь в α положение. Независимо от
химической природы уже имеющегося в α – положении заместителя преимущественное
замещение происходит в α¢ – положении.
Это можно объяснить с точки зрения электронных смещений в молекуле
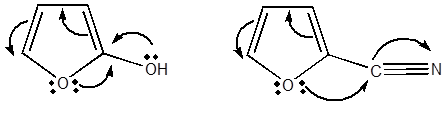
И только если
это положение занято, то замещение идет в β или β¢ - положение [3].
Гидролитическое
расщепление фуранового цикла, как правило, происходит очень легко у большинства
фурановых соединений, (исключая содержащее в ядре сильные электроотрицательные
заместители ), под влиянием даже очень сильно разбавленных растворов
минеральных кислот. Механизм реакции, приводящей в наиболее простых случаях к
образованию γ – (или 1,4 ) дикарбонильных продуктов алифатического ряда,
наиболее отчетливо выясняется на примерах расщепления фурана и его гомологов:
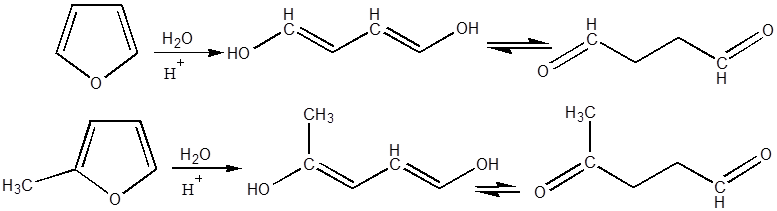
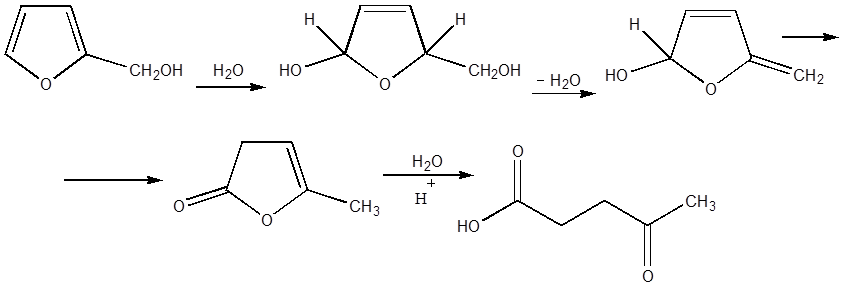
Для случая фурилкарбинолов предложено
ниже следующее схема превращений [4]:
Фурановый цикл
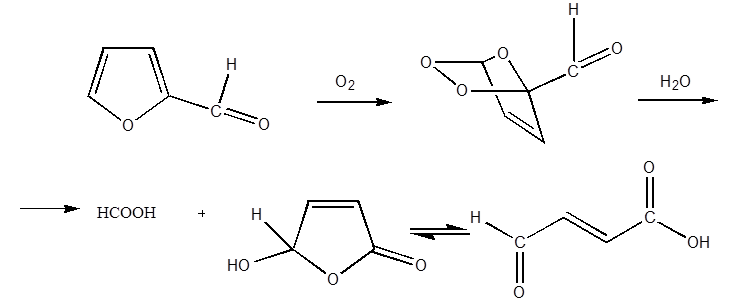
раскрывается и при действии окислителей, которые по – видимому, направляются
на 1,4 – углеродные атомы цикла. При окислении фурана кислородом воздуха с
почти количественным выходом образуется малеиновый ангидрид. Окисление
фурфурола над катализатором из молибдата железа дает малеиновую кислоту с выходом
свыше 75%
1.2
Фурановые смолы