Равновесие при адсорбции обычно характеризуют зависимостями количества вещества, поглощенного единицей массы или объема данного адсорбента, от температуры и концентрации поглощаемого вещества в парогазовой смеси или растворе; соответственно зависимость между равновесными концентрациями фаз при адсорбции имеет вид:
![]() , (39.1)
, (39.1)
или при постоянной температуре
![]() , (39.2)
, (39.2)
где ![]() – относительная
массовая концентрация поглощаемого компонента в адсорбенте, равновесная с
концентрацией адсорбтива в газовой или жидкой фазе, кг адсорбтива/кг
адсорбента;
– относительная
массовая концентрация поглощаемого компонента в адсорбенте, равновесная с
концентрацией адсорбтива в газовой или жидкой фазе, кг адсорбтива/кг
адсорбента; ![]() – относительная массовая концентрация
адсорбтива в фазе, из которой извлекается вещество,
кг адсорбтива/кг носителя газовой фазы или раствора.
– относительная массовая концентрация
адсорбтива в фазе, из которой извлекается вещество,
кг адсорбтива/кг носителя газовой фазы или раствора.
Концентрация адсорбтива ![]() может быть заменена его
парциальным давлением в парогазовой смеси р, Па, а концентрация
может быть заменена его
парциальным давлением в парогазовой смеси р, Па, а концентрация ![]() (называемая также величиной адсорбции) может
быть заменена на активность адсорбента
(называемая также величиной адсорбции) может
быть заменена на активность адсорбента ![]() , кг
адсорбтива на м3 адсорбента:
, кг
адсорбтива на м3 адсорбента:
![]() , (39.3)
, (39.3)
![]() . (39.4)
. (39.4)
Зависимости (39.2), (39.3), (39.4) представляют собой выраженные в самом общем виде уравнения линии равновесия при адсорбции, или изотерм адсорбции.
Изотермы адсорбции являются важной характеристикой адсорбционных свойств пористых твердых тел. Конкретная форма этой зависимости определяется свойствами и механизмом взаимодействия адсорбента и поглощаемого вещества. Изотермы адсорбции определяются чаще всего опытным путем. Опытные данные по равновесию адсорбции являются важным источником информации о структуре адсорбента, тепловом эффекте адсорбции и ряде других характеристик процесса.
Равновесные соотношения при адсорбции можно также описать аналитически, базируясь на основе того или иного механизма или теории процесса адсорбции.
Существует ряд теорий адсорбции: мономолекулярная, полимолекулярная, потенциальная, объемного заполнения микропор и др. В соответствии с предложенными теориями адсорбции существуют уравнения изотерм адсорбции для адсорбентов различной природы и различной структуры, используемые при расчете рабочих характеристик процесса. Конкретный вид этих уравнений приводится в литературе посвященной вопросам физической химии сорбционных процессов.
Располагая изотермой адсорбции пара стандартного вещества (обычно бензола) при температуре Т1, для какого-либо адсорбента, можно вычислить изотерму адсорбции пара другого вещества при температуре Т2 для того же адсорбента. При этом используют зависимость
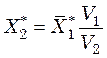 , (39.5)
, (39.5)
где ![]() – ордината
изотермы адсорбции стандартного вещества кг/кг;
– ордината
изотермы адсорбции стандартного вещества кг/кг; ![]() –
ордината определяемой изотермы кг/кг;
–
ордината определяемой изотермы кг/кг; ![]() и
и ![]() – мольные объемы стандартного и
исследуемого вещества (в жидком состоянии) соответственно, м3/кмоль.
– мольные объемы стандартного и
исследуемого вещества (в жидком состоянии) соответственно, м3/кмоль.
Адсорбция сопровождается уменьшением давления пара поглощаемого компонента в исходной смеси и заметным выделением тепла. Поэтому в соответствии с принципом Ле-Шателье количество адсорбированного вещества возрастает с понижением температуры и повышением давления. Таким образом, повышение температуры и понижение давления отрицательно влияют на процесс адсорбции.
Природа поглощаемого компонента также весьма существенно влияет на равновесие
при адсорбции. На рис. 39.1 представлены изотермы адсорбции для азота,
диоксида углерода и паров бензола. Как видно из рисунка, чем больше
молекулярная масса поглощаемого компонента, тем больше равновесная концентрация
его в абсорбенте ![]() . Для растворов характерно то,
что
. Для растворов характерно то,
что ![]() зависит в первую очередь от растворимости
поглощаемого компонента в жидкости: чем меньше растворимость, тем больше значение
зависит в первую очередь от растворимости
поглощаемого компонента в жидкости: чем меньше растворимость, тем больше значение
![]() .
.
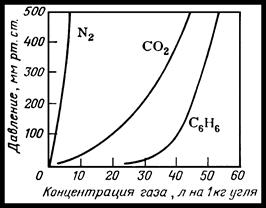
Рисунок 39.1 – Изотермы адсорбции различных газов на активном угле.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.