92Методы оценки количества и функциональной активности лимфоцитов.
О функциональной активности Т- и В-лимфоцитов можно судить по ответу в реакции бластной трансформации лимфоцитов. Бластная трансформация лимфоцитов – это переход клетки в митотический цикл после воздействия на нее активирующих факторов. Морфологически этот процесс сопровождается значительным увеличением размеров лимфоцита, увеличением его ядра, изменением ядерно-цитоплазменного соотношения. При этом бласттрансформированная клетка начинает пролиферировать, что можно зарегистрировать по скорости синтеза ДНК. Таким образом, один и тот же процесс – ответ лимфоцита на активирующее воздействие – можно регистрировать микроскопически, определяя процент бласттрансформированных клеток (тогда реакция называется реакцией бласттрансформации) или по включению меченых радиоактивным изотопом нуклеотидов, позволяющих оценить скорость синтеза ДНК (в этом случае реакция называется пролиферативным тестом).
Индукторами пролиферативной активности (или бласттрансформации лимфоцитов) могут быть:
1) митогены растительного происхождения – фитогемагглютинин (ФГА), конканавалин А, митоген фитолакки (PWM), связывающиеся через определенные рецепторы лимфоцитов и способствующие их пролиферации. Эти митогены активируют преимущественно Т-лимфоциты, а митоген фитолакки – и Т- и В-лимфоциты,
2) бактериальные полисахариды и липополисахариды (ЛПС), являющиеся тимуснезависимыми антигенами, стимулирующими пролиферацию В-лимфоцитов,
3) специфические антигены, активирующие строго определенные клоны лимфоцитов соответственно Т-клеточному рецептору.
Перечисленные активаторы вносят в суспензию иммунокомпетентных клеток, инкубируют 3-10 суток и определяют уровень пролиферации клеток.
Регистрацию пролиферативной активности осуществляют по включению меченого тритием тимидина или др. методами.
Условия получения лимфоцитов. Для получения лимфоцитов гепаринизированную венозную кровь наслаивают на градиент плотности фиколл-верографин в соотношении фиколл / кровь = 1 / 2 (см. лабораторную работу 3). Иногда реакцию проводят с цельной кровью.
Условия проведения реакции
В необходимый объем исходной полной питательной среды для культивирования лимфоцитов в лабораторных условиях (которая включает RPMI 1640 – синтетическая питательная среда, разработанная специально для культивирования клеток крови человека, эмбриональную телячью сыворотку – источник естественных ростовых факторов и белка для придания оптимального онкотического давления, раствор антибиотиком и антимикотиков для предотвращения развития бактерий и грибов) добавляем митоген в рабочей (оптимальной для достижения митогенного эффекта, определяемого соотношением рецепторов к митогену на лимфоцитах и количеством молекул митогенов в растворе) концентрации.
Рабочая концентрация в лунке ФГА min – 2,5 мкг/мл; ФГА опт – 15 мкг/мл; PWM, ЛПС, КонА – 5 мкг/мл).
В каждую лунку 96-луночной круглодонной платы вносим по 180 мкл среды (исходная среда + митоген), добавляем 20 мкл крови или суспензии лимфоцитов и ресуспендируем. Плату закрываем крышкой и инкубируем в присутствии 5 % СО2 при температуре +37о С в течение 48 часов.
Затем во все лунки вносим по 10 мкл 3Н тимидиновой метки, ресуспензируем и инкубируем при прежних условиях. По включению тимидина можно судить об уровне пролиферативной активности лимфоцитов, т.к. тимидин является одним из необходимых оснований для построения ДНК в ходе пролиферации клеток.
Затем проводим сбор клеток для регистрации включения тимидиновой метки. Эта процедура выполняется с помощью специального прибора - харвестера. Собранные клетки на фильтре помещаю в сцинтилляционную жидкость для регистрации b-излучения.
Регистрация результатов
Учет результатов проводится путем снятия показателей активности на β-счетчике, при этом количество импульсов прямо пропорционально количеству тимидина, включенного в ДНК.
Далее проводим расчет индекса стимуляции по формуле:
ИС= 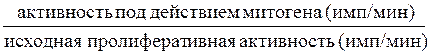
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.