5. Рассчитывают концентрацию клеток во взвеси. Глубина камеры Горяева - 0,1мм. Площадь одного большого квадрата составляет 0,04 мм2. Следовательно, объем расположенной над ним взвеси равен 0,004 мм3. Если общее число клеток, подсчитанное в 25 таких квадратах, умножить на 10, то мы получим число клеток, содержащееся в 1 мл взвеси, внесенной в камеру. Эту величину еще надо умножить на фактор разбавления исходной взвеси.
Задание 4. Изучение структурного состояния мембран тимоцитов.
Принцип метода:
Для изучения структурного состояния мембран тимоцитов можно использовать флуоресцентный зонд пирен. В возбужденном состоянии молекулы пирена способны объединяться в долгоживущие комплексы-эксимеры, испускание квантов у которых смещено в более длинноволновую область по сравнению с мономером. Эксимеризация является диффузионно-контролируемым процессом и может характеризовать микровязкость окружения зонда (рис. 1).
Измерение флуоресценции пирена при длинах волн возбуждения 286 нм и 337 нм позволяет учитывать гетерогенность липидной фазы. При возбуждении зонда светом с длинной волны 337 нм флуоресценция определяется суммарным вкладом пирена, локализованного как вблизи белка, так и в общей липидной фазе. При стимуляции флуоресценции квантами относительно низковолновой части спектра (286 нм), возникающая затем эмиссия определяется молекулами пирена, расположенными в прибелковой области, так как формируется за счет безизлучательного переноса энергии на зонд с мембранных триптофанилов.
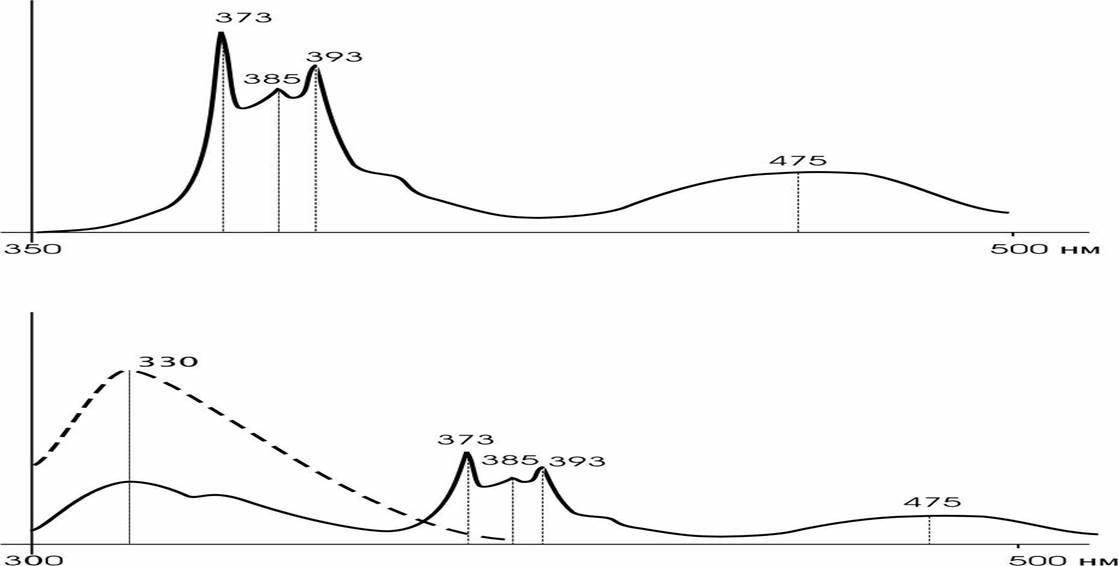
При оценке полярности липидного бислоя и аннулярного липида используется отношение интенсивности флуоресценции при 385 и 373 нм мономерной части спектра пирена (рис. 2).
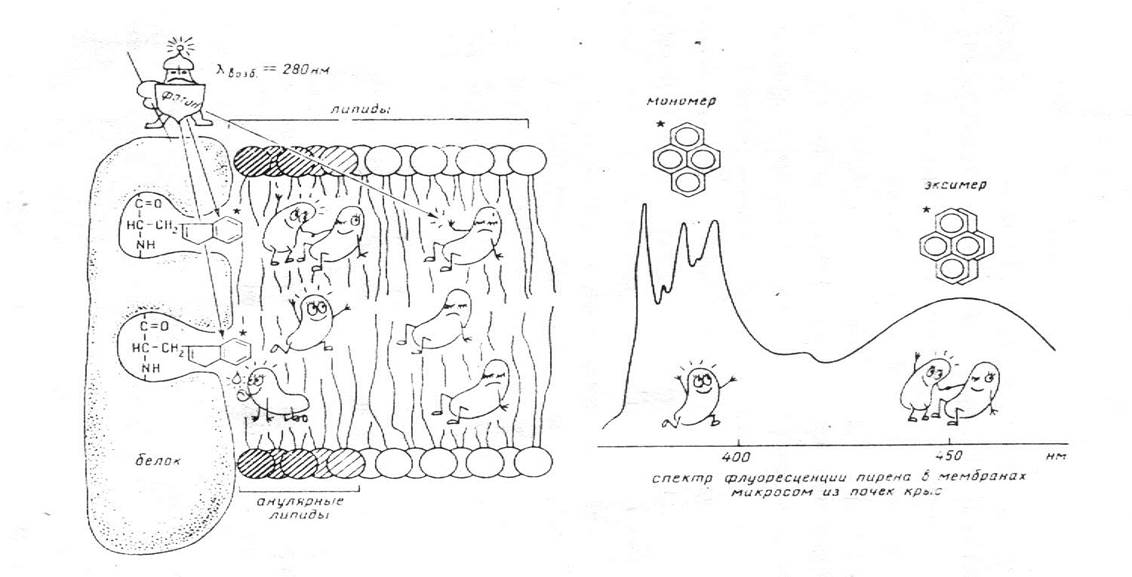
Рис. 1. Схема, иллюстрирующая собственную и вызванную флуоресценцию пирена и образование его эксимеров в мембранном бислое.
1) по интенсивности флуоресценции мембранных триптофанилов,
2) эксимеризации пирена,
3) эффективности тушения пиреном триптофановой флуоресценции,
4) полярности окружения зонда в прибелковом липидном бислое.
Регистрация спектров эмиссии осуществляется на спектрофлуориметре (SFL 1211A), при ширине щелей 8 нм со стороны возбуждения и 2 нм со стороны эмиссии в термостатируемой кювете (t = 37°С), при длинах волн возбуждения 337 и 286 нм. В последнем случае, интенсивности вибрационных полос при l = 373 и 385 нм корректируется с учетом белковой флуоресценции при указанных длинах волн и флуоресценции пирена, возбуждаемого непосредственно светом с l = 286 нм.
Материалы и оборудование: спектрофлуориметр, автоматические пипетки, кварцевая кювета, 0,5 % спиртовой раствор флуоресцентного зонда пирена.
Ход работы:
1. Готовится рабочая клеточная суспензия, концентрация клеток в которой должна составлять около 2 млн/мл.
2. В кювету наливают 2 мл рабочего раствора полученной суспензии клеток и регистрируют спектр при lвоз= 286 нм и lэм= 330 нм, т.е. собственную белковую флуоресценцию.
3. Затем в кювету с суспензией клеток добавляется 5 мкл спиртового раствора пирена (конечная концентрация при этом составляет 4 мкМ) и регистрируется спектр флуоресценции при lвоз= 337 нм и lэм= 373, 385 и 475 нм. Концентрация этанола в кювете не должна превышать одного объемного процента.
4. Далее регистрируется спектр при lвоз= 286 нм lэм= 330, 373, 385 и 475 нм.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.