















Показать студентам, что классическая теория теплоёмкости имеет ряд недостатков, которые в первую очередь проявляются в области низких и криогенных температур. Это относится ко всем веществам независимо от их агрегатного состояния. Научить студентов пользоваться квантовой теорией теплоёмкости для нахождения расчётных значений теплоёмкости при различных температурах. Показать, что лишь в области умеренных температур классическая теория теплоёмкости даёт те же результаты, что и квантовая теория.
[2] §2.1-2.8; 5.1-5.12 [6] стр. 271-277.
Пример 1. Найти среднюю кинетическую энергию ![]() вращательного движения одной молекулы
кислорода
вращательного движения одной молекулы
кислорода ![]() при температуре
при температуре ![]() ,
а также кинетическую энергию
,
а также кинетическую энергию ![]() вращательного движения
всех молекул кислорода массой
вращательного движения
всех молекул кислорода массой ![]() .
.
|
Дано: |
Решение |
|
|
Двухатомная молекула кислорода обладает двумя степенями
свободы вращательного движения: |
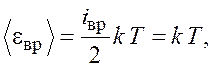 (1.1)
(1.1)
где ![]() – постоянная Больцмана;
– постоянная Больцмана; ![]() – термодинамическая температура газа.
– термодинамическая температура газа.
Кинетическая энергия вращательного движения всех молекул газа
![]() (1.2)
(1.2)
Число всех молекул газа
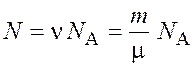 , (1.3)
, (1.3)
где ![]() – количество вещества;
– количество вещества; ![]() – постоянная Авогадро.
– постоянная Авогадро.
Подставив выражение (1.3) в формулу (1.2), получаем
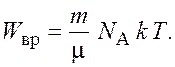 (1.4)
(1.4)
Произведем вычисления
![]() Дж;
Дж;
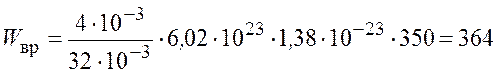 Дж.
Дж.
Ответ: ![]() Дж,
Дж, ![]() Дж.
Дж.
Пример 2. Найти концентрацию молекул одноатомного идеального газа в сосуде объемом 2,00 л при температуре 27 °С, если его внутренняя энергия равна 300 Дж.
|
Дано: |
Решение |
|
|
Концентрация молекул
где N – число молекул в объеме V. |
Внутренняя энергия газа определяется как сумма кинетических энергий всех молекул газа. Для одноатомного идеального газа
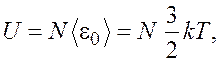
откуда число молекул
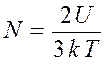 .
.
Подставив полученное выражение для числа молекул газа в формулу для концентрации, получим
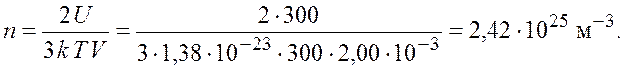
Ответ: ![]()
Пример 3. Вычислить удельную теплоемкость при
постоянном объеме ![]() и при постоянном давлении
и при постоянном давлении ![]() неона
неона ![]() и
водорода
и
водорода ![]() , принимая эти газы за идеальные.
, принимая эти газы за идеальные.
|
Дано: |
Решение |
|
|
Удельные теплоемкости идеальных газов выражаются формулами:
где |
Произведем вычисления:
– для неона
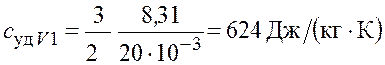 ;
;
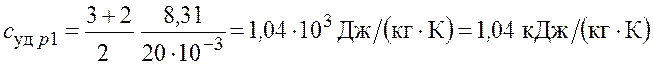 ;
;
– для водорода
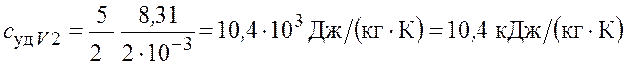 ;
;
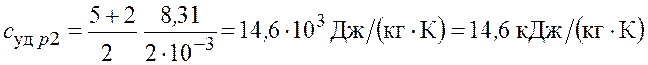 .
.
Ответ: ![]() ;
; ![]() ;
;
![]() ;
; ![]() .
.
Пример 4. Вычислить удельные теплоемкости при
постоянном объеме ![]() и при постоянном давлении
и при постоянном давлении ![]() смеси неона
смеси неона ![]() и
водорода
и
водорода ![]() , если массовые доли неона и водорода
составляют
, если массовые доли неона и водорода
составляют ![]() и
и ![]() .
Значения удельных теплоемкостей взять из предыдущего примера.
.
Значения удельных теплоемкостей взять из предыдущего примера.
|
Дано: |
Решение |
|
|
Удельную теплоемкость
|
где ![]() – удельная теплоемкость неона;
– удельная теплоемкость неона; ![]() – удельная теплоемкость водорода.
– удельная теплоемкость водорода.
Приравняв правые части выражений (4.1) и (4.2) и разделив
обе части полученного равенства на ![]() получим
получим
![]() ,
,
откуда
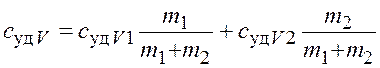 , (4.3)
, (4.3)
или
![]() , (4.4)
, (4.4)
где ![]() и
и ![]() –
массовые доли,
–
массовые доли, 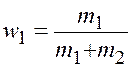 и
и 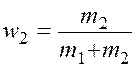 .
.
Рассуждая так же, получим формулу для вычисления удельной теплоемкости смеси при постоянном давлении
![]() . (4.5)
. (4.5)
Произведем вычисления по формулам (4.4) и (4.5)
![]()
![]() ;
;
![]()
![]() .
.
Ответ: ![]() ,
, ![]() .
.
Пример 5. Раствор состоит из двух массовых частей
воды и одной массовой части этилового спирта. Определить удельную теплоемкость
раствора. Удельная теплоемкость воды равна ![]() ,
этилового спирта –
,
этилового спирта – ![]() .
.
|
Дано: |
Решение |
|
|
Для нагревания воды, спирта и смеси на
|
где ![]() ,
, ![]() ,
, ![]() – удельные теплоемкости.
– удельные теплоемкости.
Из закона сохранения энергии следует, что
![]() . (5.4)
. (5.4)
Подставим формулы (5.1) – (5.3) в закон (5.4) и получим
![]() ,
,
откуда, с учетом ![]() ,
,
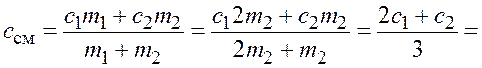
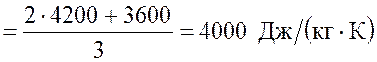 .
.
Ответ: ![]() .
.
Пример 6. В калориметр, содержащий 2,00 кг воды
температурой 15 °С, положили 1,00 кг льда температурой минус
20 °С. Какая температура установилась в калориметре? Каким оказалось
содержимое калориметра после установления в нем теплового равновесия?
Удельная теплоемкость льда – ![]() , воды –
, воды – ![]() , удельная теплота плавления льда –
, удельная теплота плавления льда – ![]() . Теплоемкость калориметра не учитывать.
. Теплоемкость калориметра не учитывать.
|
Дано: |
Решение |
|
|
Будем искать температуру смеси |
Теплота нагревания льда
![]() .
.
Теплота плавления льда
![]() .
.
Теплота нагревания воды, образовавшейся изо льда,
![]() .
.
Теплота, полученная при охлаждении воды массой ![]() ,
,
![]() .
.
Составим уравнение теплового баланса
![]() ;
;
![]() ,
,
откуда температура смеси
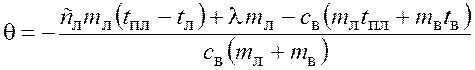 .
.
Рассчитаем температуру смеси
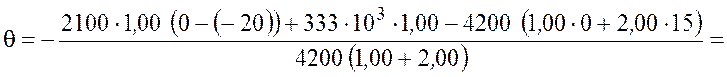
![]() .
.
Итак, получилось, что при плавлении всего льда температура в
калориметре должна была бы понизиться до минус 19,7 °С. Однако минимальная
температура воды не может быть меньше температуры плавления ![]() . Отсюда следует, что лед расплавится лишь
частично, а температура в калориметре установится
. Отсюда следует, что лед расплавится лишь
частично, а температура в калориметре установится ![]() =
0 °С.
=
0 °С.
Следовательно, за счет охлаждения воды в калориметре до ![]() лед нагревается до
лед нагревается до ![]() и часть его
и часть его ![]() расплавится.
расплавится.
Теплота нагревания льда
![]() .
.
Теплота плавления льда массой ![]()
![]() .
.
Теплота, полученная при охлаждении воды массой ![]() ,
,
![]() .
.
Составим уравнение теплового баланса
![]() ;
;
![]() ,
,
откуда масса расплавленного льда
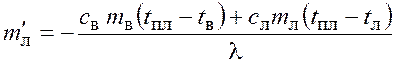 .
.
Рассчитаем массу расплавленного льда
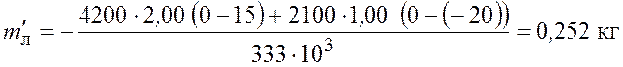 .
.
Таким образом, в калориметре после установления теплового равновесия будет лед в количестве
![]()
и вода в количестве
![]()
Ответ: ![]() = 0 °С;
= 0 °С; ![]() = 2,252 кг;
= 2,252 кг; ![]() = 0,748
кг.
= 0,748
кг.
Пример 7. Идеальный газ находится под поршнем в
вертикально расположенном цилиндре объемом 10,0 л. Температура газа
900 К, площадь поршня ![]() , масса 10,0 кг. На
сколько градусов увеличили температуру газа, если работа расширения оказалась
равной 50,0 Дж? Поршень перемещается без трения. Атмосферное давление
101 кПа.
, масса 10,0 кг. На
сколько градусов увеличили температуру газа, если работа расширения оказалась
равной 50,0 Дж? Поршень перемещается без трения. Атмосферное давление
101 кПа.
|
Дано: |
Решение |
|
|
Давление, под которым находится газ, складывается из давления атмосферы и давления, создаваемого за счет веса поршня,
Поскольку поршень перемещается без трения, то по мере расширения газа он будет перемещаться |
вверх и давление будет оставаться неизменным, т. е. процесс будет изобарным.
Работа идеального газа в изобарном процессе
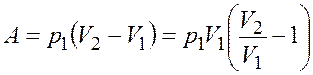 . (7.2)
. (7.2)
Отношение объемов найдем из уравнения изобарного процесса (закон Гей-Люсака)
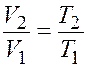 .
(7.3)
.
(7.3)
Подставив выражение (27.3) в формулу (27.2), получим
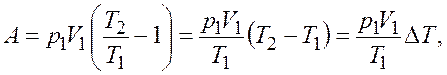
откуда с учетом соотношения (27.1)
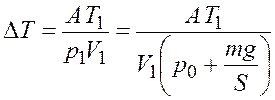 .
.
Произведем вычисления
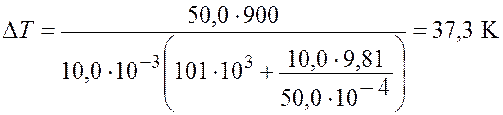 .
.
Ответ: ![]() = 37,3 К.
= 37,3 К.
Пример 8. В цилиндре под поршнем находится водород ![]() массой
массой ![]() при
температуре
при
температуре ![]() Водород сначала расширился адиабатно,
увеличив свой объем в
Водород сначала расширился адиабатно,
увеличив свой объем в ![]() раз, а затем был сжат
изотермически, причем объем газа уменьшился в
раз, а затем был сжат
изотермически, причем объем газа уменьшился в ![]() раз.
Найти температуру в конце адиабатного расширения и работу, совершенную газом
при этих процессах. Изобразить процесс графически.
раз.
Найти температуру в конце адиабатного расширения и работу, совершенную газом
при этих процессах. Изобразить процесс графически.
|
Дано: |
Решение |
|
|
Графическое изображение процессов дано на рис. 8.1. Температуры и объемы газа, совершающего адиабатный процесс, связаны между собой соотношением
где
|
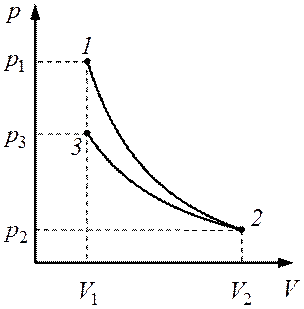
Рис. 8.1
Для двухатомной молекулы водорода ![]() ,
поэтому
,
поэтому ![]() .
.
Из соотношения (8.1) получаем следующее выражение для конечной температуры:
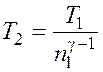 .
.
Работа ![]() газа при адиабатном
расширении может быть определена по формуле
газа при адиабатном
расширении может быть определена по формуле
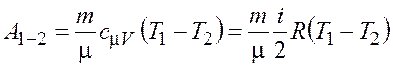 .
.
Работа ![]() газа при изотермическом
процессе может быть выражена в виде
газа при изотермическом
процессе может быть выражена в виде
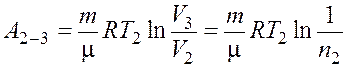 .
.
Произведем вычисления
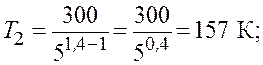
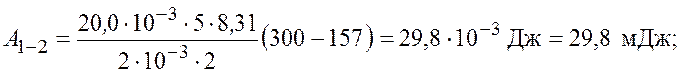
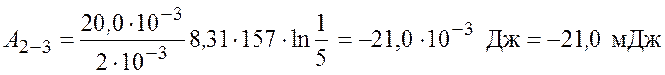 .
.
Отрицательное значение работы ![]() означает,
что при сжатии работа над газом совершается внешними силами.
означает,
что при сжатии работа над газом совершается внешними силами.
Ответ: ![]() ,
, ![]()
![]()
Пример 9. Кислород ![]() массой
массой ![]() занимает объем
занимает объем ![]() и
находится под давлением
и
находится под давлением ![]() . Газ был нагрет
сначала при постоянном давлении до объема
. Газ был нагрет
сначала при постоянном давлении до объема ![]() а
затем при постоянном объеме до давления
а
затем при постоянном объеме до давления ![]() Найти
изменение
Найти
изменение ![]() внутренней энергии газа, совершенную им
работу
внутренней энергии газа, совершенную им
работу ![]() и теплоту
и теплоту ![]() ,
переданную газу. Построить график процесса.
,
переданную газу. Построить график процесса.
|
Дано: |
Решение |
|
|
Графическое изображение процессов показано на рис. 9.1. Рис. 9.1 |
Изменение внутренней энергии идеального газа не зависит от процессов
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.