Для идеального газа с постоянными теплоемкостями
U = CV×T, I = Cp×T.
Пользуясь приведенными выше соотношениями, выражениям для U и / можно придать вид
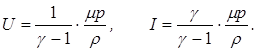
Точное измерение величины CV затруднительно. Практически удобнее измерить величину Cp и g, а теплоемкость вычислить по формуле СV = Сp /g. Кроме того, отношение теплоемкостей играет большую роль при процессах близких к адиабатическим. В частности, от него зависит скорость звука в газовых средах, параметры течения газов со звуковыми и сверхзвуковыми скоростями по трубам и в соплах.
При адиабатическом обратимом процессе термодинамические параметры р и V связаны уравнением Пуассона
![]()
В дифференциальном виде оно имеет вид
g×p×dV + V×dp = 0 (1)
В связи с этим g называют показателем адиабаты.
Скоростью звука VЗВ называют скорость, с которой распространяются в сжимаемых средах малые возмущения давления, и, в частности, звуковые волны.
Характерные значения скорости, с которой звук распространяется в нормальных условиях, для большинства реальных сред лежат в следующих пределах: для газов и паров - от 150 до 1000 м/с, для жидкостей от 750 до 2000 м/с, для твердых тел от 2000 до 6000 м/с.
Внутреннюю энергию и теплосодержание идеального газа можно выразить через скорость звука:
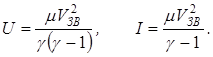 (3)
(3)
Задачей данной работы является измерение величины отношения теплоемкостей воздуха, скорости звука и молярных величин внутренней энергии и энтальпии.
Измерения проводятся по методу, предложенному Клеманом и Дезормом (1819 г.). Стеклянный баллон вместимостью в несколько литров (рисунок 1) наполняют воздухом при атмосферном давлении. С помощью насоса в баллон дополнительно накачивают небольшую порцию воздуха, затем кран k1 закрывают. Спустя несколько минут температура газа в баллоне сравнивается с температурой t0 окружающего воздуха. После этого водяным манометром измеряют давление р1 газа в баллоне. Затем на короткое время открывают кран К2 . При этом часть воздуха выходит из баллона, и его давление сравнивается с атмосферным р0. Газ, оставшийся в баллоне, адиабатически расширяется, вследствие чего его температура понижается до значения Т2. Затем кран К2 закрывают и газ начинает медленно нагреваться, пока его температура не
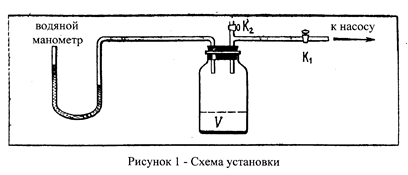 |
Для того, чтобы показать это, мысленно выделим внутри баллона произвольную порцию воздуха, ограниченную замкнутой поверхностью объёмом V (рисунок 1). В моменты отсчётов давления параметры, характеризующие состояние газа внутри поверхности, имеют следующие значения:
1-е состояние: р1, T0, V1;
2-е состояние: p0, T2, V2;
3-е состояние: р3, T0, V2.
Разности давлений р1 – р0 и р3 – р1 в сотни и тысячи раз меньше атмосферного давления p0, а поэтому для упрощения вычислений с этими разностями можно обращаться как с бесконечно малыми дифференциалами. То же относится к соответствующим изменениям объема выделенной порции воздуха. Переход газа из состояния 1 в состояние 2 совершается адиабатически и соответствующие изменения давления и объема связаны уравнением адиабаты (1). Полагая в нем dV = V2 – V1, dp = p0 – р1, можно записать
gp(V2 – V1) + V(p0 – p1) = 0. (4)
В состояниях же 1 и 3 температуры газа одинаковы, и поэтому в этих состояниях произведение pV одно и то же (pV = const). Следовательно
PdV + Vdp =0,
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.