Министерство образования Российской Федерации
Сибирский государственный индустриальный университет
Кафедра физики
ОПРЕДЕЛЕНИЕ ПОКАЗАТЕЛЯ АДИАБАТЫ ВОЗДУХА МЕТОДОМ КЛЕМАНА-ДЕЗОРМА
Методические указания к выполнению лабораторной работы
по курсу «Общая физика»
Новокузнецк
2001
УДК 531
О62
Рецензент
Кандидат технических наук, доцент каф. физики металлов СибГИУ
Определение показателя адиабаты воздуха методом Клемана-Дезорма: Метод, указ. / Сост.: Е.А. Будовских, В.А. Петрунин, Н.Н. Назарова, В.Е. Громов: СибГИУ.- Новокузнецк, 2001.- 13с.
В работе определяется показатель адиабаты воздуха, скорость звука в нем и молярные величины внутренней энергии и энтальпии. Непосредственно измеряются: начальное избыточное давление газа в сосуде; время, в течение которого газ находится при постоянном давлении после адиабатического расширения при открытом кране сосуда; соответствующее этому времени избыточное давление, возникающее в сосуде после закрытия крана при изохорном нагреве. Измерения проводятся при различных значениях времени.
Работа предназначена для студентов всех специальностей.
При изменении состояния термодинамической системы в общем случае меняется и ее температура.
Величина С, определяемая формулой
D =CdT
когда приток тепла dQ отнесен к одному молю системы, называется молярной теплоемкостью. Её значение зависит от вида процесса изменения состояния. При адиабатическом процессе в теплоизолированной системе, когда dQ = 0, теплоемкость равна нулю. Если состояние изменяется изотермически (dТ = 0), то теплоемкость равна бесконечности.
Согласно первому началу термодинамики подводимое к системе тепло dQ в расчете на один моль в процессе малого изменения его состояния связано с изменением внутренней энергии системы dU и работой рdV , совершаемой системой, соотношением
DQ = dU + pdV
Где p - давление;
V- молярный объем.
Из этого уравнения следует, что при изохорическом изменении состояния (dV = 0)
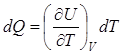
Соответствующая теплоемкость 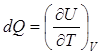 называется теплоемкостью при постоянном объеме.
называется теплоемкостью при постоянном объеме.
Помимо внутренней энергии в термодинамике используется еще одна важная для ряда практических приложений функция состояния I, называемая теплосодержанием или энтальпией,
I = U + pV,
или
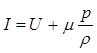
где m - молярная масса;
r - плотность системы. При изобарическом изменении состояния, когда dp=0,
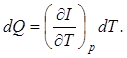
Величина 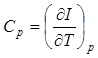 называется теплоемкостью при постоянном давлении.
называется теплоемкостью при постоянном давлении.
Таким образом, если объем системы остается постоянным, то приток тепла равен приращению внутренней энергии системы, если же постоянно давление, то он выражается приращением энтальпии.
Так как для идеального газа I = U(T) + pV, то теплосодержание такого газа, как и его внутренняя энергия, есть функция только температуры. Теплоемкости Сp и СV идеального газа и их отношение g = Cp/CV тоже зависят только от температуры; при этом
Cp – CV =R,
где R - универсальная газовая постоянная.
Так как R > 0 и СV > 0, то всегда g > 1.
Согласно классическому результату статистической
физики энергия молекул газа, находящегося в равновесном состоянии, распределяется
одинаковыми долями по всем степеням свободы возможных движений молекулы.
Энергия, приходящаяся на одну степень свободы, составляет в расчете на один
моль ![]() . Таким образом, если i - число степеней свободы
движения молекулы, внутренняя энергия одного моля газа U равна
. Таким образом, если i - число степеней свободы
движения молекулы, внутренняя энергия одного моля газа U равна
![]()
С учетом уравнения состояния pV = RT молярное теплосодержание идеального газа
![]()
Соответственно теплоемкости Сp и СV и их отношение у даются формулами
![]()
Таким образом, теплоемкости находящегося в равновесном состоянии идеального газа с равномерным распределением энергии по степеням свободы постоянны.
Наименьшее число степеней свободы - три - имеют одноатомные газы (при нормальных условиях - это гелий Не, неон Nе и др., при высокой температуре - полностью диссоциированные кислород О, азот N и др.). Для таких газов g = 5 / 3, и это значение хорошо подтверждается экспериментальными данными. Газы с очень сложными молекулами имеют большое число внутренних степеней свободы и для них g® 1. Таким образом, величина g для идеальных газов заключена в пределах 1 < g < 5 / 3.
Классический результат статистической физики не дает правильного представления о распределении энергии по колебательным степеням свободы молекул, а при очень низких температурах - и по вращательным степеням свободы молекул. Так, для двухатомной молекулы (О2, Н2 и др.) число степеней свободы i = 7 (три поступательных, две вращательных -вокруг главных осей, две колебательные - симметричные и антисимметричные колебания вокруг центра масс), и согласно классической теории g =9/7.
Однако, как следует из квантовой теории, теплоемкости двухатомных молекул при постоянном объеме
при Т<<q ![]() и
и ![]()
при Т>>q ![]() и
и ![]()
где q - характеристическая колебательная температура (q для кислорода равна 2273 К, для азота - 3393 К).
Таким образом, отношение теплоемкостей у двухатомных газов при нормальной температуре с большой точностью равно 7/5 и, постепенно уменьшаясь с ростом температуры, лишь при температуре в несколько тысяч градусов (меньшей, чем температура, при которой существенную роль начинает играть диссоциация) приближается к значению 9/7, следующему из классической теории.
У воздуха, представляющего собой в основном смесь двухатомных газов - азота и кислорода, значения у при нормальных условиях близки к 7/5, т.е. 1,40.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.