Радиолиз конкретных разбавленных растворов мы рассмотрим позже в разделе химическая дозиметрия. А пока-
Радиолиз концентрированных водных растворов
В концентрированных растворах возрастает вклад прямого действия ИИ, т.е. непосредственного воздействия ИИ на раствореное вещество – ионизация и возбуждение ионов и молекул вторичными электронами. Но, как правило, образующийся продукт возникает как за счет прямого, так и косвенного действия ИИ.
G(П) = G(П) Н20* fН2О + G(П)s *fs,
Где G(П) Н20 –РХВ продукта, образовавшегося за счет взаимодействия растворенного вещества и продуктов радиолиза воды,
G(П)s – за счет прямого действия ИИ, fН2О и fs – электронные доли воды и растворенного вещества.
Если уравнение разделить на электронную долю воды, то оно примет вид –
G(П)/ fН2О = G(П) Н20+ G(П)s *(fs,/ fН2О) и тогда, откладывая экспериментальные результаты в такой системе координат мы получаем возможность вклад прямого и косвенного действия ИИ.
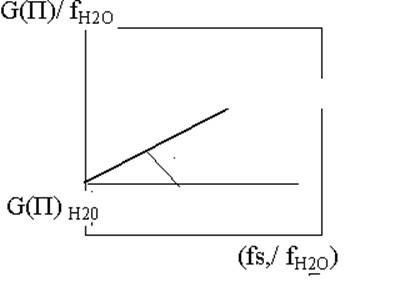
G(П)s= tgα
На практике было показано, что при радиолизе концентрированных растворов нитратов (а это промышленные отходы переработки ядерного топлива) G(NO2-)>>G(-H2O), что однозначно свидетельствует о наличии прямого действия ИИ. Есть мнение, что это процесс диссоциативной ионизации.
NO3- → •NO2- + O +e-
NO3- +O→ NO2- + O2 поскольку G(NO2-) = 4,0 молекул/100 эВ для 1 – 6М, а для разбавленных растворов G(NO2-) = 0,4 молекул/100 эВ
Кроме того, при концентрациях более 0,1 М наблюдается уменьшение РХВ сольватированного электрона. Считается, что еще до сольватации акцептор успевает прореагировать с сухим электроном, т.е. идет конкуренция процессов
е- + S→S-
е- →еaq за время менее 10-14с.
Второй важный момент, который необходимо учитывать – реакции дырочных продуктов:
Н2О+ + С1 - → Н2О +С1•
Н2О+ + NO3-→ Н2О+• NO3
И, наконец, рассматривая радиолиз концентрированных растворов следует помнить о том, что такие параметры как вязкость, коэффициент активности, диэлектрическая проницаемость и др. у них существенно отличаются от таковых для разбавленных растворов. Это уже почти не растворы. В них проявляются элементы структурирования и это следует учитывать в эксперименте.
Некоторые методические приемы, используемые в РХ
Как мы уже обсуждали в прошлом семестре, РХ методы давно применяются для получения данных о механизмах различных химических реакций в которых участвуют СР, сольватированннй электрон, ионы, т.е. для накопления общехимических знаний.
При взаимодействии растворенных веществ с е-aq и Н* образуются продукты восстановления, а при взаимодействии с O- и ОН* - продукты окисления. Поскольку при облучении растворов РХВ восстановителей и окислителей оказываются примерно одинаковыми, в итоге получается смесь веществ, что затрудняет понимание механизмов процессов, протекающих в системе. Поэтому, чтобы понять эти механизмы и научиться управлять этими процессами используют прием ТРАНСФОРАЦИИ СР.
1. При насыщении растворителя закисью азота происходит конверсия сольватированного электрона в ОН* ,
е-aq+ N2O (Н2О) → N2 +ОН* + ОН-aq
Константа скорости этой реакции очень велика - порядка 1010 л/моль.с
Поэтому в результате мы получаем практически удвоение количества радикалов
ОН* в реакционной системе.
Кроме закиси азота для подобной конверсии можно использовать персульфат, периодат, гипобромид в щелочной среде.
S2O82-- +е-aq→SO4--* +SO42—
SO4--* + ОН-aq→OH* +SO42—
BrO-- + е-aq→ Br-- + O—
O-- + Н2О → ОН* + ОН-aq
2. Восстановительные условия можно реализовать двумя способами:
Первый – Газообразный водород под давлением прокачивают через щелочную среду. Н2 + ОН*→ H*+ Н2О
Второй – добавление спиртов – RH + ОН*→ R*+ Н2О (R*- как правило –восстановитель).
3. Добавление в реакционную систему кислорода – аэрация (20- 30 мин барботажа кислорода через изучаемый раствор).
Н*+ О2 →НО*2 R*+ О2→ RО*2
е-aq + О2 → О2*_ НО*2→ О2*_ + Н+ (рК = 4,5)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.