КАМЧАТСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ
УНИВЕРСИТЕТ
КАФЕДРА ЭКОЛОГИИ И ХИМИИ
ХИМИЯ
Задания к контрольной работе № 2 для студентов второго курса
направления 280200.62 «Защита окружающей среды»
заочной формы обучения
ПЕТРОПАВЛОВСК-КАМЧАТСКИЙ,
2011
УДК 543
ББК 24.4
С.22
Составитель: Саушкина Л.Н., к.б.н., доцент
Рецензент: Ступникова Н.А., к.б.н., доцент
Химия. Задания к контрольной работе № 2 для студентов второго курса направления280200.62 «Защита окружающей среды» заочной формы обучения. – Петропавловск-Камчатский: КамчатГТУ, 2011. – 16 c.
Контрольная работа составлена в соответствии с Государственным образовательным стандартом высшего, профессионального образования «Требования к обязательному минимуму содержания и уровню подготовки бакалавра» по направлению 280200.62 «Защита окружающей среды», утвержденного приказом Министерства образования Российской Федерации от 21.03.2000 г.
Утверждены на заседании кафедры экологии и химии КамчатГТУ
протокол № 9 от 20 января 2011 г
ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Курс химии для студентов, обучающихся по направлению 280200.62 «Защита окружающей среды», изучается в течение двух лет. В данном пособие содержатся задания к контрольной работе № 2, которую студенты выполняют на втором курсе. В конце пособия приведены примеры решения типовых задач.
Контрольная работа включает 7 вопросов и задач. Таблица вариантов контрольных заданий приведена в конце пособия. Каждый студент выполняет вариант контрольных заданий, обозначенный двумя последними цифрами шифра. Контрольная работа, выполненная не по своему варианту, преподавателем не рецензируется и не зачитывается.
Контрольная работа выполняется в отдельной тетради в клетку. Решения задач и ответы на теоретические вопросы должны быть коротко и четко обоснованы. При решении задач нужно приводить весь ход решения и математические преобразования, избирая простейший путь решения. Контрольная работа должна быть аккуратно оформлена; для замечаний рецензента надо оставлять поля не менее 4 см; писать надо четко и ясно; номера и условия задач следует переписывать в том порядке, в каком они указаны в задании.
В конце контрольной работы необходимо указать, какими учебниками или учебными пособиями студент пользовался при выполнении контрольной работы. Работа должна быть датирована и подписана студентом.
Если контрольная работа при рецензировании не зачтена, исправления следует выполнять в конце тетради, а не в рецензированном тексте.
ЗАДАНИЯ К КОНТРОЛЬНОЙ РАБОТЕ
1. Рассчитайте растворимость оксалата кальция в воде.
2. Рассчитайте растворимость сульфида марганца в воде.
3. Рассчитайте растворимость в воде хромата бария.
4. Рассчитайте произведение растворимости хлорида серебра, если растворимость AgCl при 20оС равна 0,0016 г/дм3.
5. Рассчитайте, растворимость хлорида серебра.
6. Рассчитайте растворимость сульфида кадмия в воде.
7. Рассчитайте растворимость сульфата свинца в воде.
8. Рассчитайте растворимость сульфата бария в воде.
9. Рассчитайте растворимость сульфида цинка в воде.
10. Рассчитайте растворимость сульфата кальция в воде.
11. Рассчитайте растворимость хромата свинца в воде.
12. Рассчитайте концентрацию водородных ионов и рН 0,1 н. раствора NaOH, степень диссоциации которого 84%.
13. Рассчитайте концентрацию водородных ионов и рН раствора муравьиной кислоты 0,46% концентрации (r=1 г/см3).
14. Рассчитайте концентрацию водородных ионов и рН раствора, полученного разбавлением водой 100 см3 4% раствора HClдо 1дм3.
15. Рассчитайте концентрацию водородных ионов и рН раствора, полученного разбавлением водой 500 см3 4% раствора HClдо 1дм3.
16. Рассчитайте концентрацию водородных ионов и рН 0,1 н. раствор NH4OH.
17. Рассчитайте концентрацию водородных ионов и рН раствора, в 200 см3 которого содержится 1,2 г СН3СООН.
18. Рассчитайте концентрацию водородных ионов и рН раствора в 1000 мл которого содержится 0,63 г HNO3.
19. Рассчитайте концентрацию водородных ионов и рН раствора муравьиной кислоты, в 50 cм3 которого содержится 2,30 г НСООН.
20. Рассчитайте концентрацию водородных ионов и рН раствора, в 100 cм3 которого содержится 1,12 г КОН.
21. Рассчитайте концентрацию водородных ионов и рН раствора, в 750 cм3 которого содержится 4,5 г. СН3СООН.
22. Рассчитайте концентрацию водородных ионов и рН 0,1 н раствора, HCl, степень диссоциации которого равна 91 %.
23. Рассчитайте концентрацию водородных ионов и рН раствора в 100 мл которого содержится 0,6 г уксусной кислоты.
24. Рассчитайте концентрацию водородных ионов и рН 0,6 % раствора уксусной кислоты.
25. Определите концентрацию водородных ионов и рН ацетатного буферного раствора состава: 0,5 М СН3СООН + 0,5 М СН3СООNa
26. Определите концентрацию водородных ионов и рН буферного раствора состава: 0,5 М NH4OH + 0,5 M NH4Cl
27. Определите концентрацию водородных ионов и рН буферного раствора состава: 0,2 М НСООН + 0,2 M НСООNa.
28. Определите концентрацию водородных ионов и рН буферного раствора состава: 1 М NH4OH + 1 M NH4Cl.
29. Определите концентрацию водородных ионов и рН буферного раствора состава: 0,1 М NaHСO3 + 0,1 M Na2СO3..
30. Определите концентрацию водородных ионов и рН буферного раствора состава: 1 М НСООН + 1 M НСООК
31. Определите концентрацию водородных ионов и рН буферного раствора состава: 0,5 М KH2PO4 + 0,5 M K2HPO4.
32. Определите концентрацию водородных ионов и рН буферного раствора состава: 1 М СН3СООН + 0,5 М СН3СООК.
33. Вычислите, сколько граммов перманганата калия нужно взять, чтобы приготовить 1,5 дм3 приблизительно 0,05 н. раствора для перманганатометрических определений.
34. Вычислите, сколько граммов бихромата калия нужно взять, чтобы приготовить 1,5 дм3 0,02 н. раствора для йодометрических определений.
35. Вычислите, сколько граммов нитрата серебра нужно взять, чтобы приготовить 250 мл приблизительно 0,01 н. раствора.
36. Вычислите, сколько граммов хлорида натрия нужно взять, чтобы приготовить 100 мл приблизительно 0,1 н. раствора.
37. Вычислите, сколько граммов тетрабората натрия нужно взять, чтобы приготовить 500 мл 0,25 н. раствора.
38. Вычислите, сколько граммов щавелевой кислоты нужно взять, чтобы приготовить 250 мл 0,05 н. раствора для перманганатометрических определений.
39. Вычислите, сколько граммов тиосульфата натрия нужно взять, чтобы приготовить 2,0 дм3 0,01 н. раствора для йодометрических определений.
40. Рассчитайте навеску технического нитрита натрия, содержащего приблизительно 85% % NaNO2, нужную для приготовления 100 см3 0,05 н. раствора для перманганатометрических определений.
41. Вычислите сколько граммов гидроксида натрия нужно растворить в воде, чтобы приготовить 500 мл раствора с титром, равным 0,0004032 г/мл.
42. Вычислите титр раствора хлорида натрия, в 250 мл которого содержится 0,7142 г х. ч. хлорида натрия.
43. Вычислите нормальность раствора перманганата калия, если в 1 литре растворено 3,16 г KMnO4.
44. Вычислите массу тетрабората натрия, необходимую для приготовления 500 мл 0,1 н. раствора.
45. Вычислите нормальность раствора перманганата калия, если в 500 мл растворено 1,8750 г KMnO4.
46. Рассчитайте навеску безводного карбоната натрия, необходимую для приготовления 250 см3 0,1 н. раствора.
47. На титрование 20 см3 0,5 н. раствора карбоната натрия было израсходовано 18,5 см3 соляной кислоты. Вычислите нормальность раствора соляной кислоты.
48. На титрование 20 см3 0,5 н. раствора карбоната натрия было израсходовано 18,5 см3 соляной кислоты. Вычислите титр раствора соляной кислоты.
49. На титрование 25 см3 соляной кислоты было израсходовано 10,2 см3 раствора гидроксида натрия с титром, равным 0,003825 г/мл. Вычислите нормальность раствора соляной кислоты.
50. На титрование 25 см3 соляной кислоты было израсходовано 10,2 см3 раствора гидроксида натрия с титром, равным 0,003825 г/мл. Вычислите титр раствора соляной кислоты.
51. На титрование 25 см3 раствора сульфата железа (II) израсходовано 24,5 см3 0,05 н. раствора перманганата калия. Рассчитайте нормальность раствора FeSO4.
52. На титрование 25 см3 раствора сульфата железа (II) израсходовано 24,5 см3 0,05 н. раствора перманганата калия. Рассчитайте титр раствора FeSO4.
53. На титрование 25 см3 0,045 н. раствора оксалата аммония израсходовано 24 см3 раствора перманганата калия. Рассчитайте титр раствора перманганата калия.
54. На титрование 25 см3 0,045 н. раствора оксалата аммония израсходовано 24 см3 раствора перманганата калия. Рассчитайте нормальность раствора перманганата калия.
55. На титрование пробы раствора NaCl израсходовано 14,5 см3 раствора AgNO3 с титром по хлору 0,001694 г/см3. Вычислите вес NaCl в пробе.
56.
На титрование 20 см3 щавелевой
кислоты с ![]() расходуется 20,1 см3 раствора KMnO4. Рассчитайте титр и
нормальность раствора перманганата
расходуется 20,1 см3 раствора KMnO4. Рассчитайте титр и
нормальность раствора перманганата
57.
Вычислите, сколько граммов Н3РО4
содержится в пробе раствора, если на ее титрование в присутствии индикатора фенолфталеина
израсходовано 18,25 см3 раствора NaOH с ![]() ?
?
58. В мерной колбе на 200 см3 растворена навеска 1,0606 г х.ч. Na2CO3. На титрование 20 см3 этого раствора в присутствии индикатора метилового оранжевого израсходовано 24,45 см3 раствора HCl. Рассчитайте титр и нормальность раствора.
59. Вычислите нормальность раствора перманганата калия, если на титрование 25 мл 0,01 н. раствора было израсходовано 14,8 мл перманганата калия.
60. Из 0.5376 г х.ч. NaCl приготовлен раствор в мерной колбе емкостью 200 см3. На титрование 20 см3 этого раствора расходуется 19,0 см3 раствора AgNO3. Вычислите нормальность и титр раствора нитрата серебра по хлору.
61. Дайте определение понятию «система». Открытая, закрытая, изолированная, гомогенная и гетерогенная системы.
62. Дайте три формулировки I-го начала термодинамики.
63. Формулировка закона Гесса (с примером термохимической реакции).
64. Дайте определения самопроизвольным, обратимым и необратимым процессам. Приведите примеры.
65. Понятие о равновесии. Устойчивое, метастабильное, неустойчивое. Условия равновесия.
66. Возможность протекания экзо- и эндотермических процессов с точки зрения изменения энергии Гиббса.
67. Влияние температуры на скорость реакции, теория активации.
68. Механизм гомогенного катализа с примерами.
69. Основные положения гетерогенного катализа. На каком явлении он основан?
70. Фазовые равновесия. Правило фаз Гиббса.
71. Причины электролитической диссоциации, её механизм.
72. Отличие грубодисперсных и коллоидных систем от истинных растворов.
73. Классификация коллоидных систем, основные способы их получения.
74. Виды устойчивости коллоидных систем. Седиментационный анализ.
75. Строение мицелл коллоидных растворов.
76. Коагуляция золей. Правило Щульце-Гарди.
77. Микрогеторогенные системы, их классификация.
78. ПАВ, их строение. Моющее действие мыла.
79. Оптическое строение коллоидных систем.
80. Показать строение мицеллы, образующейся при реакции: AgNO3(ИЗБЫТОК) + KJ →.
ПРИМЕРЫ РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ
Задача: Вычислить ПРа, AgCl, зная, что насыщенный раствор AgCl при 25оС содержит 1,86·10-3 г соли в 1 л воды.
Решение:
Находим молярную концентрацию насыщенного раствора AgCl, которая численно будет равна растворимости хлорида серебра. Учитывая, что молекулярный вес AgCl равен 143,3, получим:
СМ, AgCl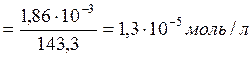
Из уравнения диссоциации AgCl ↔ Ag+ + Cl–видно, что каждая грамм-молекула дает при растворении по 1 г-ион Ag+ и Cl- и это значит, что концентрации ионов Ag+ и Cl в насыщенном растворе будут равны концентрации AgCl.
Следовательно,
ПРс,AgCl = ![]() =1,3·10-5·1,3·10-5=1,78·10-10
=1,3·10-5·1,3·10-5=1,78·10-10![]() ПРа, AgCl
ПРа, AgCl
Задача: Вычислить растворимость Mg(OH)2 в воде.
Решение:
По таблице № 1 (приложение) находим, что произведение растворимости гидроксида магния равно ПРа=6,0·10-10.
Обозначим искомую растворимость ( в моля на литр) через
Х. Эти Х моль Mg(OH)2 прейдя в раствор, создадут в нем следующие
концентрации ионов: ![]() ;
; ![]()
Т.е. ПРС=![]() =Х·(2Х)2=4Х3=6,0·10-10
=Х·(2Х)2=4Х3=6,0·10-10
Откуда Х![]()
Чтобы перейти к растворимости, выраженной в граммах на 1 л (У), найденное значение умножим на молекулярный вес Mg(OH)2, равный 58,31. При этом получим:
У![]() 5,3·10-4·58,31=3,1
г/л
5,3·10-4·58,31=3,1
г/л
Задача: Рассчитайте концентрацию водородных ионов и рН раствора, в 100 см3 которого содержится 0,6 г СН3СООН.
Решение:
Так как уксусная кислота является слабым электролитом,
диссоциирующим на два иона, то концентрацию ионов водорода можно вычислить по
формуле: [Н+] = ![]() ,
,
Где К – константа ионизации уксусной кислоты, К = 1,74∙10-5 (таблица приложения).
Скислоты – молярная концентрация уксусной кислоты.
Молярная концентрация вычисляется по формуле:
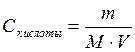 , где
, где
m – масса вещества, m = 0,6 г;
M – молярная масса, для уксусной кислоты М = 60 г/моль;
V – объем раствора, V = 0,1 л
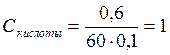 моль/л
моль/л
[Н+] = ![]() =
4,17∙10-3 г-ион/л
=
4,17∙10-3 г-ион/л
Водородный показатель среды (рН) вычисляется по формуле:
рН = - lg [H+] = – lg 4,7∙10-3 = 3 – lg 4,7 = 3 – 0,67 = 2,33
Задача: Рассчитайте концентрацию водородных ионов и рН 0,011 М раствора КOH, степень диссоциации которого 90%.
Решение:
Гидроксид натрия является сильным электролитом. Процесс его диссоциации выражается следующей химической реакцией: KOH → K+ + OH – .
Концентрация гидроксид ионов составляет 90% от равна молярной концентрации щелочи, т.е.
[OH –] = 0,011∙0,9 = 0,0099 ≈ 0,01 = 10-2 г-ион/л
Концентрация ионов водорода и гидроксильных групп связаны
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.