621.3
К65
№895
Конструирование и технология микросхем и микропроцессоров.
Методические указания к лабораторной работе №6.
Лабораторная работа № 6
1. Цель
работы.
2.1 Модель
Дила-Гроува.
При объяснении экспериментальных результатов чаще всего используют модель, предложенную Дилом и Гроувом. В соответствии с ней предполагается, что слой двуокиси формируется на поверхности кремния за счет химической реакции с окислителем, в качестве которого используется сухой и влажный кислород или пары воды. Соответствующие реакции:
![]() , (1)
, (1)
![]() .(2)
.(2)
Процесс
осуществляется в кварцевых реакторах при температурах 900…1200°С. При более высоких
температурах скорость роста увеличивается, но одновременно ухудшается качество
пленки, искажаются диффузионные профили для примесей, введенных на более
ранних этапах технологического процесса, резко сокращается срок службы
кварцевой оснастки.
Термическая двуокись кремния обладает более высокими
характеристиками, чем аналогичные пленки, полученные осаждением из газовой
фазы, так как обеспечивают более низкую плотность поверхностных состояний на
границе раздела ![]() , что очень важно для
МДП-транзисторов, имеют более высокую плотность и меньшую пористость.
, что очень важно для
МДП-транзисторов, имеют более высокую плотность и меньшую пористость.
Количественно процесс окисления может быть описан
на основе модели трех потоков (см. рисунок). Определим поток как число атомов,
пересекающих заданную единичную площадку за единицу времени. Поток окислителя,
поступающий из газовой фазы к поверхности окисла ![]() ,
переносится затем через уже образовавшуюся пленку
,
переносится затем через уже образовавшуюся пленку ![]() и
вступает в химическую реакцию с кремнием у границы раздела
и
вступает в химическую реакцию с кремнием у границы раздела ![]() .
.
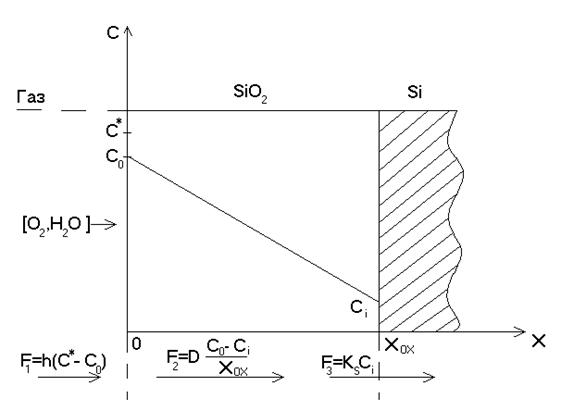
Модель термического окисления кремния
Рассмотрим
поток ![]() , его величина пропорциональна разности
концентрации в газовой фазе около поверхности окисла
, его величина пропорциональна разности
концентрации в газовой фазе около поверхности окисла ![]() и
равновесной концентрации в поверхностном слое
и
равновесной концентрации в поверхностном слое ![]() .
.
![]() , (3)
, (3)
где ![]() - коэффициент массопереноса в газовой фазе.
В соответствии с законом Генри
- коэффициент массопереноса в газовой фазе.
В соответствии с законом Генри
![]() связано с парциальным давлением
связано с парциальным давлением ![]() окислителя в газовой фазе
окислителя в газовой фазе
![]() , (4)
, (4)
где
![]() - коэффициент Генри.
- коэффициент Генри.
Поток окислителя через окисел определяется диффузионным переносом в
соответствии с 1-м законом Фика
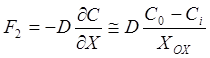 , (5)
, (5)
где
![]() - концентрация окислителя на границе
раздела
- концентрация окислителя на границе
раздела ![]() ;
; ![]() - коэффициент диффузии окислителя
через пленку
- коэффициент диффузии окислителя
через пленку ![]() .
.
Поток ![]() обусловлен протеканием химической реакции
взаимодействия окислителя с кремнием в соответствии с (1) и (2) и может быть
записан в виде
обусловлен протеканием химической реакции
взаимодействия окислителя с кремнием в соответствии с (1) и (2) и может быть
записан в виде
![]() . (6)
. (6)
В условиях равновесия все 3 потока равны, поэтому можно записать
![]() . (7)
. (7)
Приравняв
(3) и (5), (5) и (6) и решив относительно ![]() и
и ![]() , получаем связь между концентрациями:
, получаем связь между концентрациями:
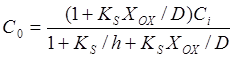 , (8)
, (8)
![]() . (9)
. (9)
Таким образом, поток окислителя через границу раздела ![]()
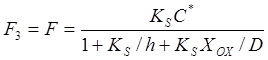 . (10)
. (10)
Этот же поток можно выразить и через скорость роста окисла (через количество образующегося в единицу времени окисла)
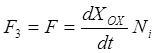 , (11)
, (11)
здесь
![]() - количество молекул окислителя,
необходимых для образования единичного объема окисла. Концентрация
- количество молекул окислителя,
необходимых для образования единичного объема окисла. Концентрация ![]() - 2,2×1022см-3,
для ее обеспечения необходимо 2,2×1022
молекул кислорода или 4,4×1022 молекул
воды.
- 2,2×1022см-3,
для ее обеспечения необходимо 2,2×1022
молекул кислорода или 4,4×1022 молекул
воды.
Решая совместно (10) и (11), получаем для скорости окисления
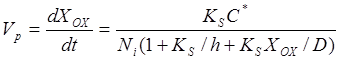 . (12)
. (12)
Решив уравнение (12), найдем толщину окисла, выросшего за время t
![]() , (13)
, (13)
![]() , (14)
, (14)
![]() . (15)
. (15)
Параметр
![]() зависит в основном от первоначальной
толщины окисной пленки, всегда присутствующей на поверхности кремния после
пребывания на воздухе при комнатной температуре (в нормальных условиях она
составляет 1…4 нм).
зависит в основном от первоначальной
толщины окисной пленки, всегда присутствующей на поверхности кремния после
пребывания на воздухе при комнатной температуре (в нормальных условиях она
составляет 1…4 нм).
Общепринятая форма записи уравнения (13)
![]() . (16)
. (16)
Величину
![]() можно вычислить по формуле
можно вычислить по формуле
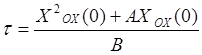 . (17)
. (17)
Коэффициент
![]() принято называть параболической константой
скорости окисления, так как при длительном времени окисления (
принято называть параболической константой
скорости окисления, так как при длительном времени окисления (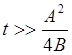 ) изменение толщины со временем описывается
параболическим законом
) изменение толщины со временем описывается
параболическим законом
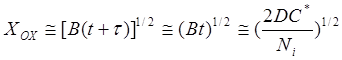 . (18)
. (18)
При малых временах окисления толщина окисла
линейно зависит от времени (при 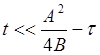 )
)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.