 (Берестецкий, с 153)
(Берестецкий, с 153)![]() Для атома водорода поправка к гамильтониану порядка
Для атома водорода поправка к гамильтониану порядка 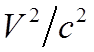 :
:
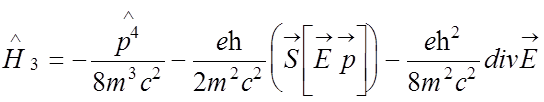 ;
;
![]() Первый член
– релятивистская зависимость энергии от импульса.
Первый член
– релятивистская зависимость энергии от импульса.
![]() Второй – спин-орбитальное взаимодействие. Его можно
представить в виде:
Второй – спин-орбитальное взаимодействие. Его можно
представить в виде:
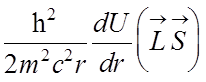
![]() Среднее значение оператора
Среднее значение оператора ![]() можно
найти из нерелятивистского УШ:
можно
найти из нерелятивистского УШ:
(Ландау стр.150)
__ _______________
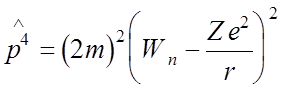 ,
,
где 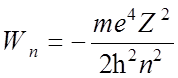 - энергия
невозмущенного уровня.
- энергия
невозмущенного уровня.
![]() Учет только релятивистской зависимости энергии
приводит к добавке:
Учет только релятивистской зависимости энергии
приводит к добавке:
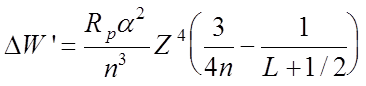 ,
,
где
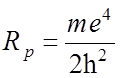 - постоянная Ридберга,
- постоянная Ридберга, 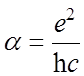 - постоянная тонкой структуры.
- постоянная тонкой структуры.
![]() Спин-орбитальное взаимодействие вносит добавку энергии:
Спин-орбитальное взаимодействие вносит добавку энергии:
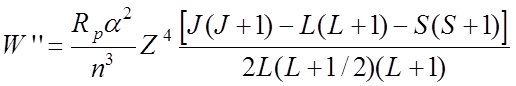
Здесь
использовано : 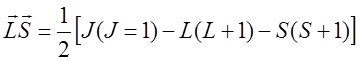
![]() В результате для S = 1/2 и L = J
± 1/2 полная энергия уровня равна (тонкая структура)
В результате для S = 1/2 и L = J
± 1/2 полная энергия уровня равна (тонкая структура)
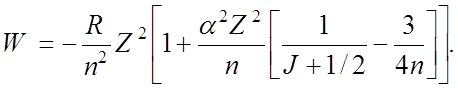
![]() Последовательность уровней атома H с учетом тонкой
структуры:
Последовательность уровней атома H с учетом тонкой
структуры:
![]()
![]()
![]()
![]()
![]()
![]()
подчеркнутые термы остаются вырожденными в рамках модели релятивистских поправок. Их вырождение снимается в результате учета радиационных поправок (лэмбовский сдвиг).
![]()
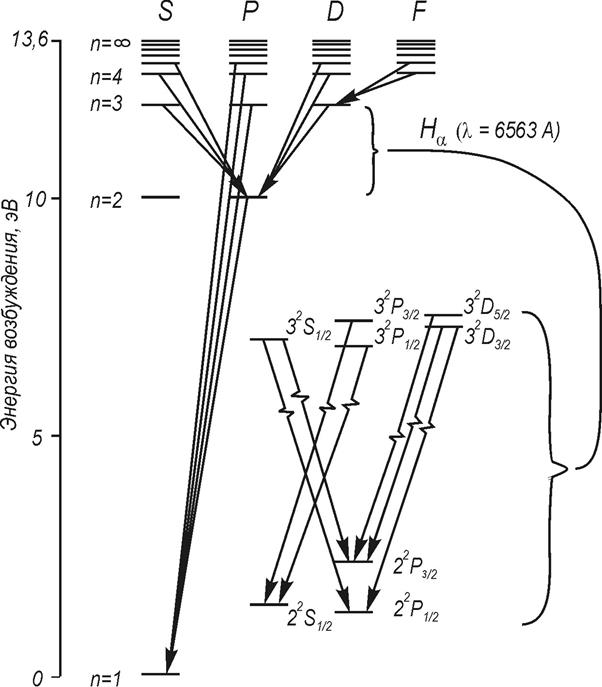
Пример тонкого расщепления уровней для линии Нα приведен на диаграмме Гротриана для водорода
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Для атома с числом электронов N энергия спин - орбитального взаимодействия равна:
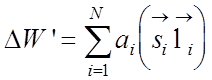
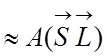 ,
,
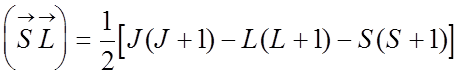 .
.
.
![]() Мультиплетное
расщепление:
Мультиплетное
расщепление:
Таким образом, в результате релятивистских эффектов уровень с данными значениями L и S расщепляется на ряд уровней с различными значениями J. Об этом расщеплении говорят как о тонкой структуре или мультиплетном расщеплении уровня.
![]()
![]() Уровень с данным L и S расщепляется на 2S+1 (при L>S)
или на 2L+1 (при S>L) подуровней. Каждый из этих уровней остается вырожденным относительно
направления
Уровень с данным L и S расщепляется на 2S+1 (при L>S)
или на 2L+1 (при S>L) подуровней. Каждый из этих уровней остается вырожденным относительно
направления ![]() ,
т.е. 2J+1 раз.
,
т.е. 2J+1 раз.
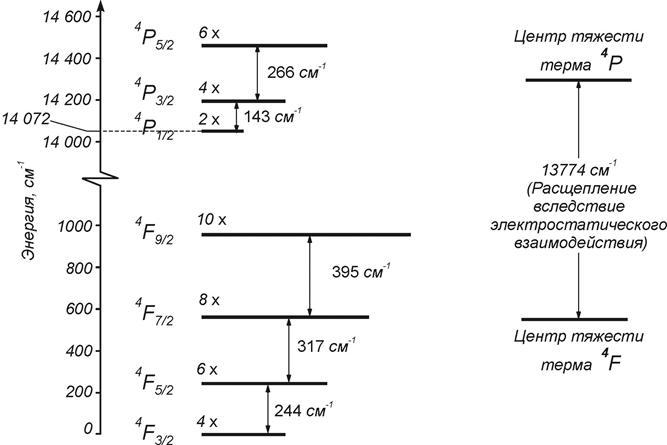
Сравнение электростатического и электромагнитного взаимодействий в атоме на примере Cr.3+ (3d3 )
![]() Правило
интервалов Ланде: расстояние между соседними подуровнями с различными J
равно
Правило
интервалов Ланде: расстояние между соседними подуровнями с различными J
равно
![]() ,
,
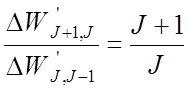
![]() Пример: терм 5DJ (S
= 2 и L = 2, J = 0, 1,2, 3, 4).
Пример: терм 5DJ (S
= 2 и L = 2, J = 0, 1,2, 3, 4).
Интервалы относятся:
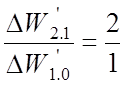 ;
; 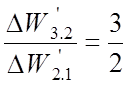 ;
; 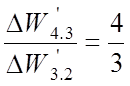 .
.
Сравнение с экспериментом:
правило интервалов для атомов Mg, Ca, Sr, Zn, выполняется с точностью до 2,5 %, тогда как для тяжелых элементов, например Hg, точность уменьшается до ~ 30% .
![]() Приближение
центрально-симметричного поля в сложном атоме (одноэлектронное приближение)
Приближение
центрально-симметричного поля в сложном атоме (одноэлектронное приближение)
Электростатическое взаимодействие электронов учитывается усредненным центрально-симметричным хартри-фоковским полем:
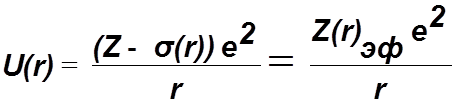 ,
,
Zэф(r) – эффективный заряд ядра действующий на электрон на расстоянии r.
![]() Два
принципа построения электронных оболочек
Два
принципа построения электронных оболочек
принцип
Паули:
только один электрон в (n, ![]() ,
, 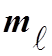 , ms)- состоянии
, ms)- состоянии
принцип минимума энергии: из возможных состояний осуществляется состояние с минимальной энергией.
![]() Энергия электрона (!) в атоме определяется: (Ельяшевич,194 и далее)
Энергия электрона (!) в атоме определяется: (Ельяшевич,194 и далее)
· зарядом ядра Z – энергия понижаются с ростом Z
· главным квантовым числом n– энергия связи уменьшается с ростом n
· орбитальным моментом![]() – энергия связи растет
с уменьшением
– энергия связи растет
с уменьшением ![]() при заданном n (проникающие
орбиты).
при заданном n (проникающие
орбиты).
· взаимодействием электронов в подоболочке –
при данном ![]() энергия связи растет для
различных
энергия связи растет для
различных 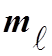 (орбиты пространственно разнесены)- правило Хунда (Бейзер, 209)
(орбиты пространственно разнесены)- правило Хунда (Бейзер, 209)
![]() Последовательность заполнения оболочек
Последовательность заполнения оболочек
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 6d, 7s.
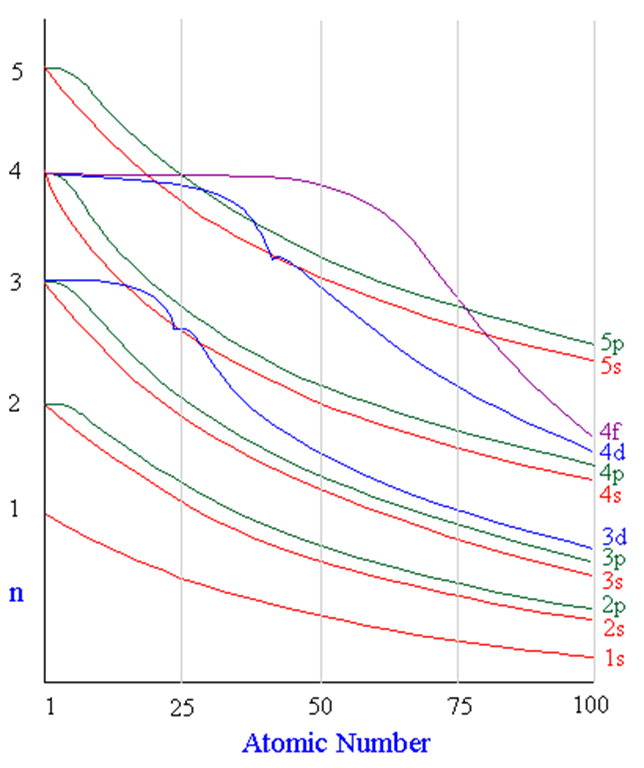 |
![]() Максимальное число электронов в оболочке и подоболочке
с данными n,
Максимальное число электронов в оболочке и подоболочке
с данными n, ![]()
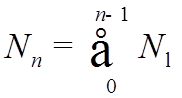 ,
, ![]() , →
, → 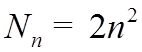
Оболочка |
n |
Максимальное число электронов в подоболочке |
Всего электронов в оболочке |
||||
|
s |
p |
d |
f |
g |
|||
|
1 |
2 |
2 |
||||
|
L |
2 |
2 |
6 |
8 |
|||
|
M |
3 |
2 |
6 |
10 |
18 |
||
|
N |
4 |
2 |
6 |
10 |
14 |
32 |
|
|
O |
5 |
2 |
6 |
10 |
14 |
18 |
50 |
![]()
Зависимости
энергий связи электронов от Z, n и ![]()
![]()
|
1s электрона атома H (Z = 1) – эффект увеличения Z .
Li – Z = 3, третий электрон в 2s –состоянии, 5,4 эВ – эффект влияния n.
|
При заданном Z и n оболочка с меньшим ![]() расположена глубже, то есть s глубже р и т.д. эффект
понижения
расположена глубже, то есть s глубже р и т.д. эффект
понижения![]()
Однако с ростом Z энергия связи атомов растет (т.е. эффект Z преобладает).
|
![]() Такая картина заполнения электронных
оболочек характерна для всей последовательности элементов, однако влияние
Такая картина заполнения электронных
оболочек характерна для всей последовательности элементов, однако влияние ![]() в тяжелых
атомах становится существеннее.
в тяжелых
атомах становится существеннее.
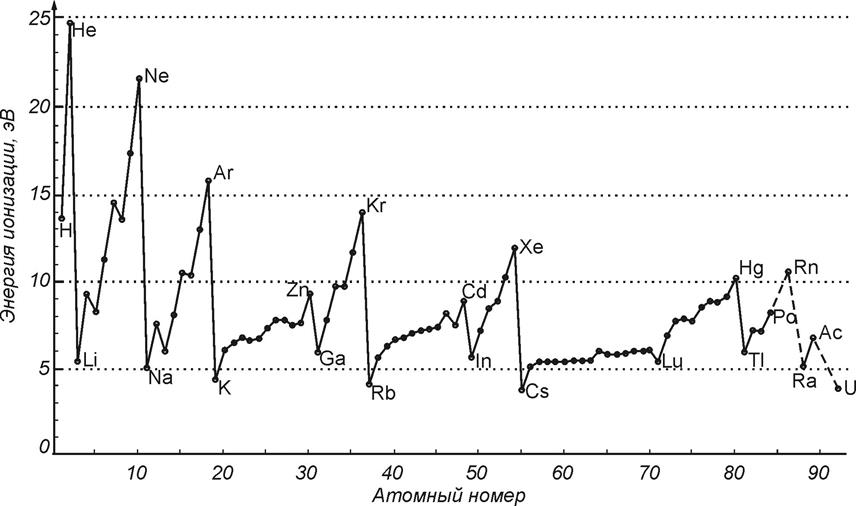
![]() Потенциал ионизации
Потенциал ионизации
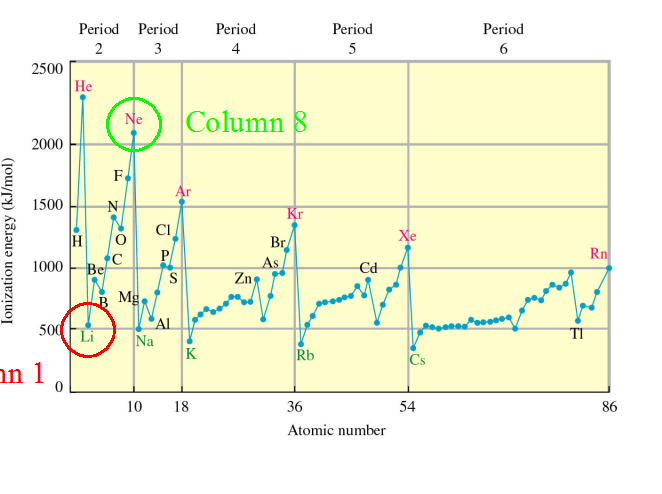
1 kJ/mol = .010364 eV/atom
![]() Таблица Менделеева (1869)
Таблица Менделеева (1869)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.