скоростей реакции сольволиза в зависимости от состава растворов.
|
Содержание спирта, об% |
Диэлектрическая проницаемость ε |
Константа скорости сольволиза, kּ1000 c-1 |
||||
|
Метод |
Среднее значение |
Литературное значение |
||||
|
Аппроксимация |
Интегральный |
Дифференциальный |
||||
|
0 |
78,3 |
25,0±0,2 |
23,2±0,3 |
23,4±0,6 |
23,8 |
- |
|
21,5 |
74,2 |
6,02±0,03 |
5,99±0,04 |
5,64±0,11 |
5,88 |
6,76 |
|
25,1 |
73,4 |
5,93±0,04 |
5,43±0,05 |
5,56±0,11 |
5,64 |
- |
|
30,2 |
72,2 |
3,34±0,02 |
3,06±0,03 |
3,42±0,06 |
3,27 |
3,55 |
|
35,4 |
70,9 |
2,36±0,03 |
2,04±0,03 |
2,38±0,04 |
2,26 |
1,45 |
|
40,7 |
69,4 |
1,14±0,01 |
1,14±0,03 |
1,13±0,02 |
1,14 |
1,05 |
|
45,3 |
68,0 |
0,920±0,003 |
0,917±0,004 |
0,89±0,01 |
0,91 |
- |
|
49,5 |
66,6 |
0,550±0,001 |
0,555±0,001 |
0,55±0,01 |
0,55 |
0,367 |
Как можно видеть из таблицы 1 литературные значения и данные, полученные в настоящей работе, довольно хорошо совпадают друг с другом. Расхождения можно объяснить различными методами определения констант.
Если исходить из модели взаимодействия зарядов в растворе, предложенной
для этой реакции выше, то зависимость константы скорости от диэлектрической
проницаемости среды выражается как 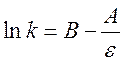 . По данным табл. 1.
построена зависимость усредненного значения константы от 1/ε (рис. 19). Все
точки с хорошей точностью лежат на прямой, что доказывает правильный выбор
модели для описания данной системы.
. По данным табл. 1.
построена зависимость усредненного значения константы от 1/ε (рис. 19). Все
точки с хорошей точностью лежат на прямой, что доказывает правильный выбор
модели для описания данной системы.
4. Выводы
В результате проделанной работы найдены значения констант скорости сольволиза трет-бутилхлорида в водно-спиртовых растворах различного состава. Реакция изучалась кондуктометрическим методом. Полученные данные электропроводности растворов обрабатывали тремя различными способами (интегральным, дифференциальным и методом аппроксимации экспоненциальной функцией), причем полученные таким образом константы хорошо сходятся между собой. Была построена зависимость lnk от 1/ε, которая является линейной, что соответствует предложенной нами модели описания данной системы.
5. Приложение
На рисунках 1-8 приведены графики зависимости удельной электропроводности (УЭП) водно-спиртовых растворов в мСм/см от времени в секундах, а также представлены результаты их математической обработки по методу 1.
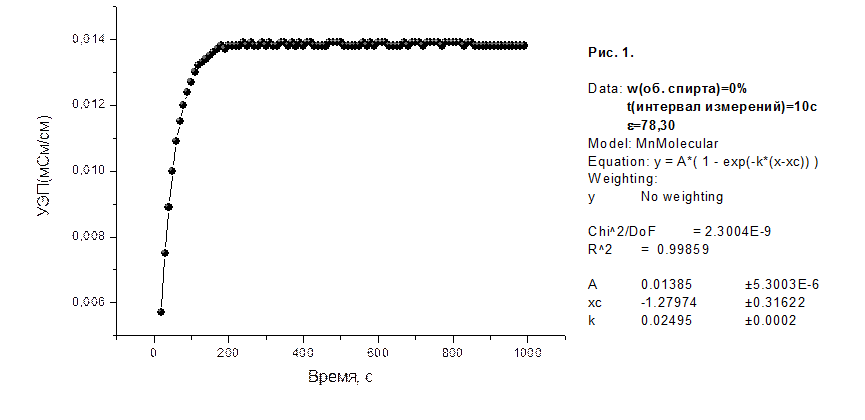
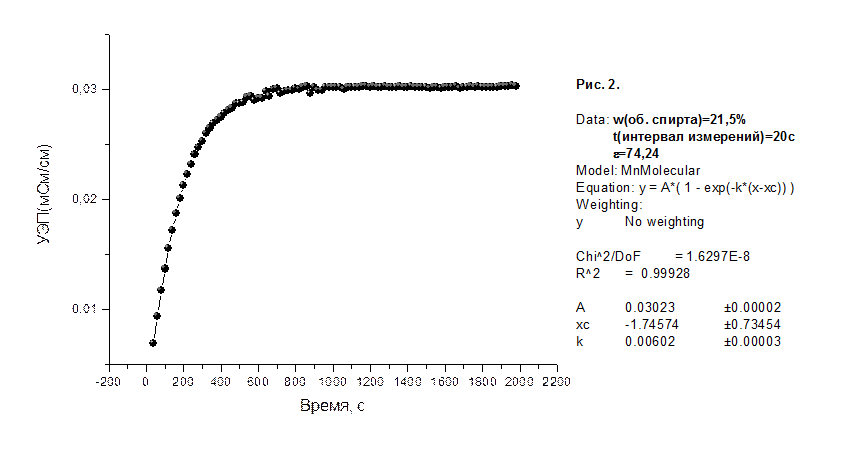
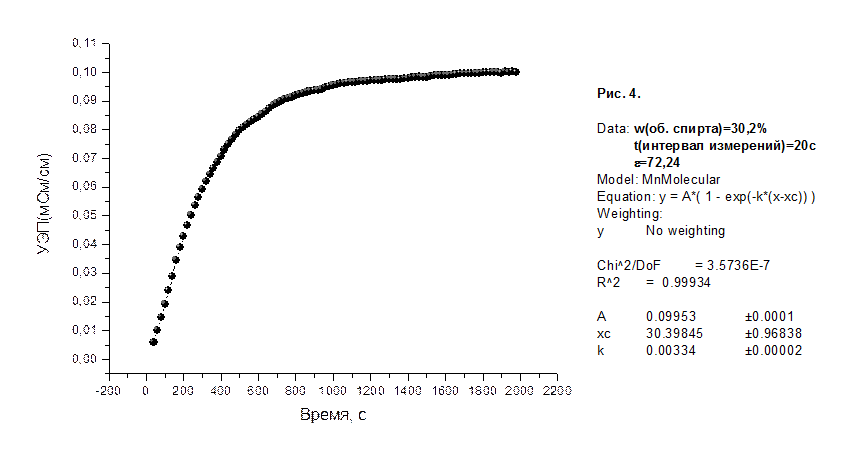
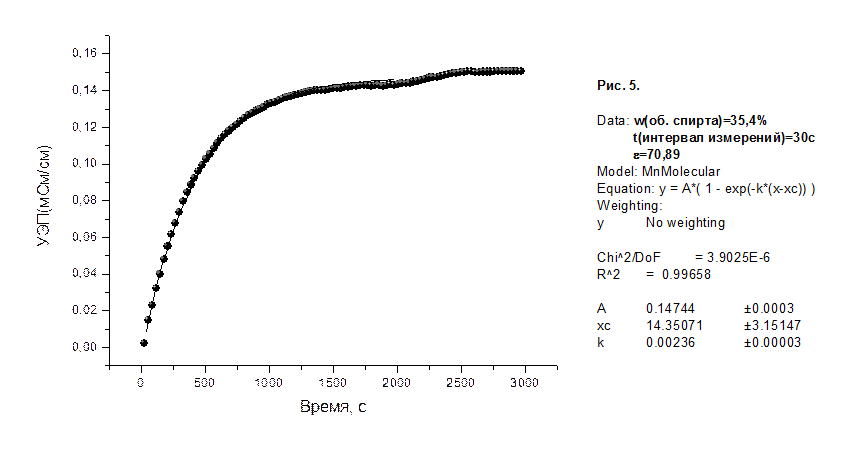
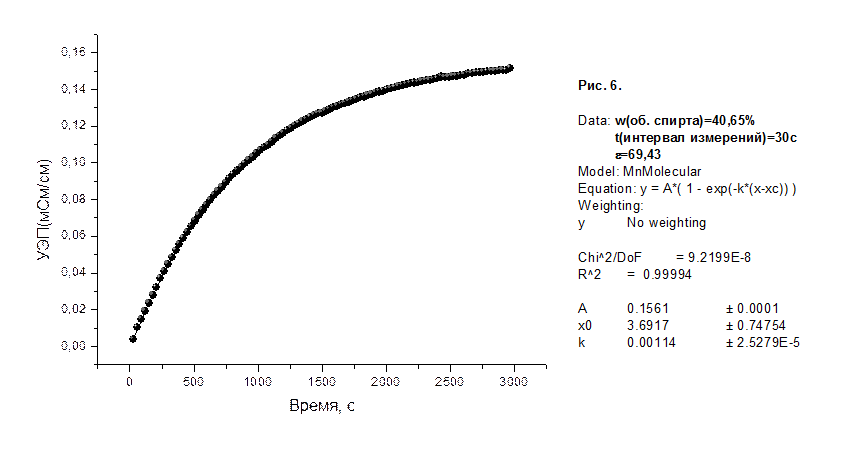
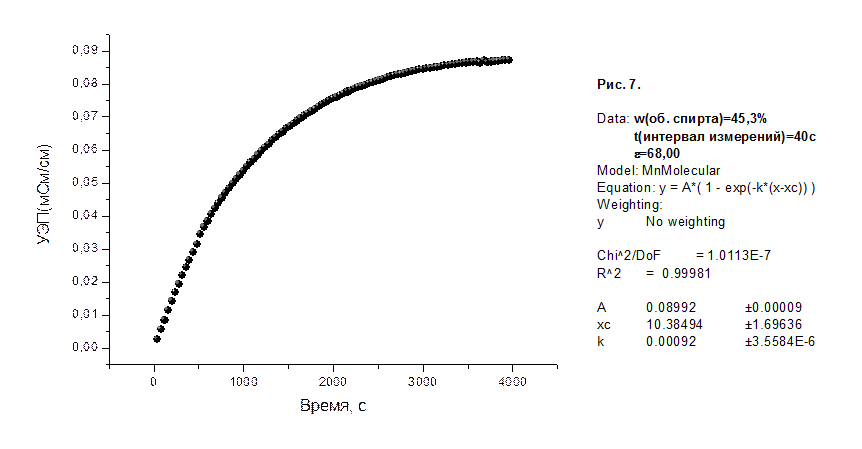
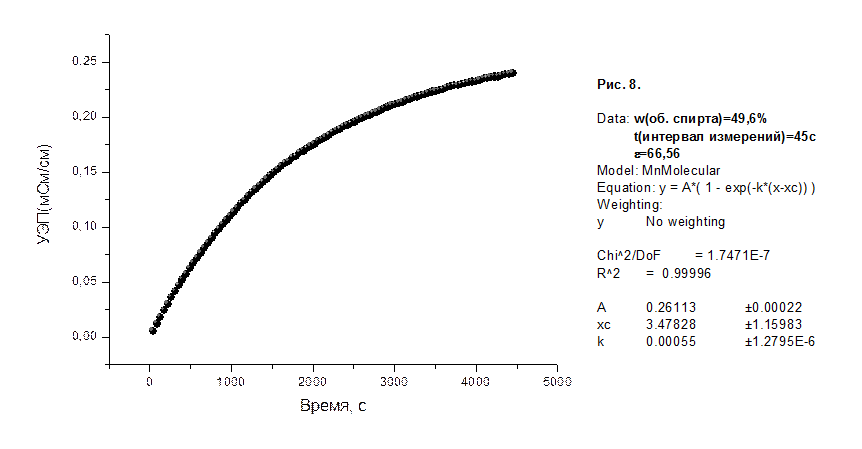
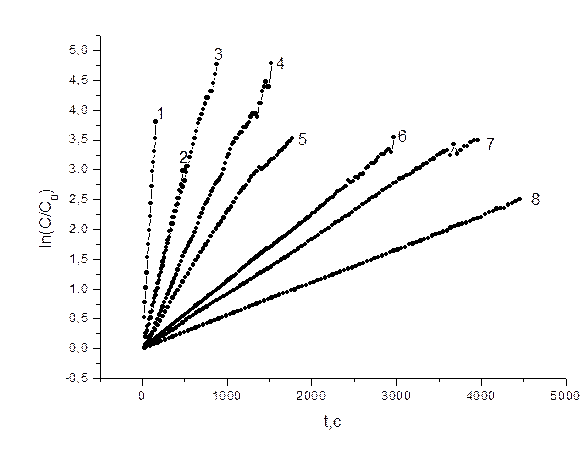
Рис. 9. Расчет
константы скорости реакции по интегральному методу. Цифрами 1-8 показаны
зависимости 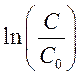 от t для
водно-спиртовых растворов различного состава (от 0 до 49,58% соответственно)
от t для
водно-спиртовых растворов различного состава (от 0 до 49,58% соответственно)
На рисунках 10-18 приведены графики зависимости скоростей реакции водно-спиртовых растворов в молях/лּс от концентрации соляной кислоты в молях/л, а также представлены результаты их математической обработки по методу 3.
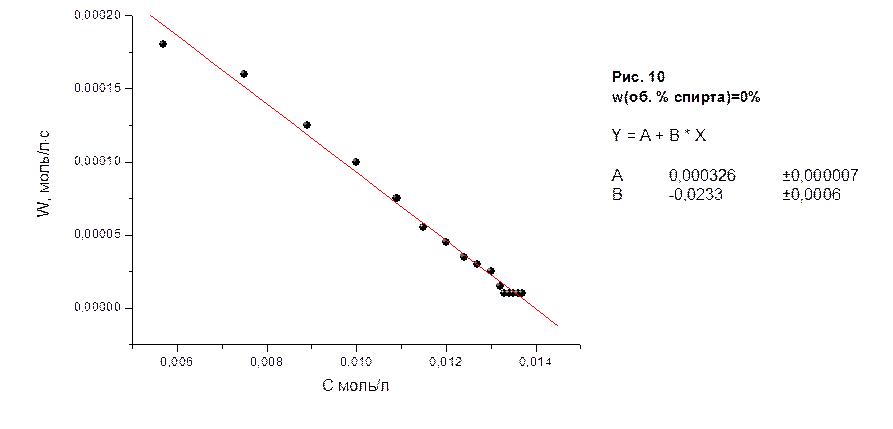
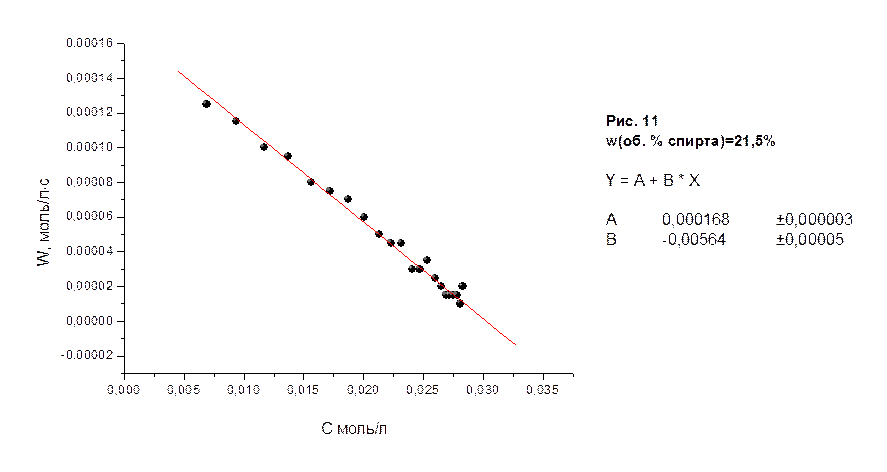
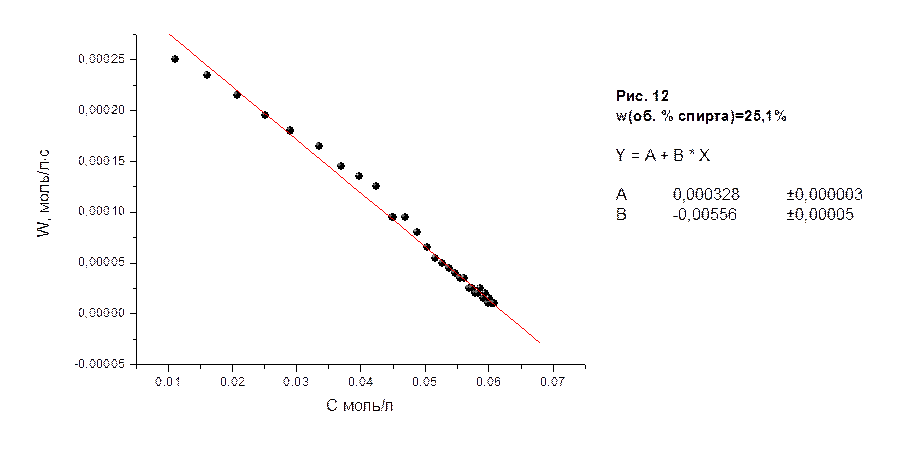
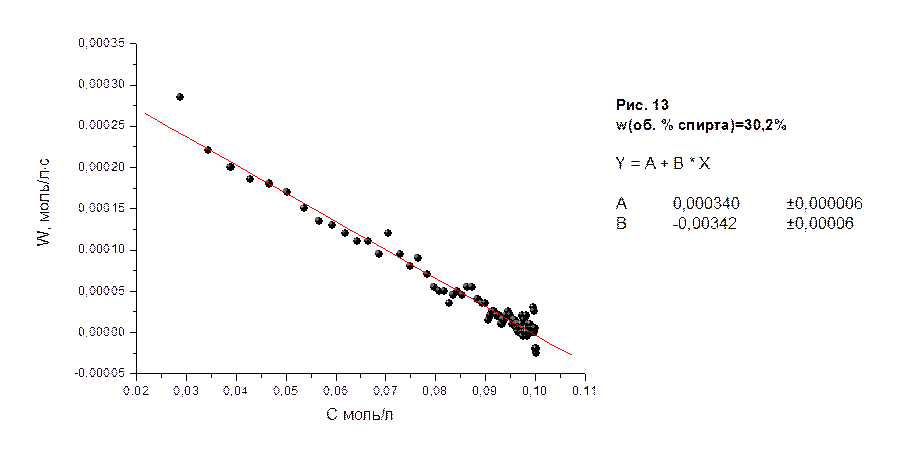
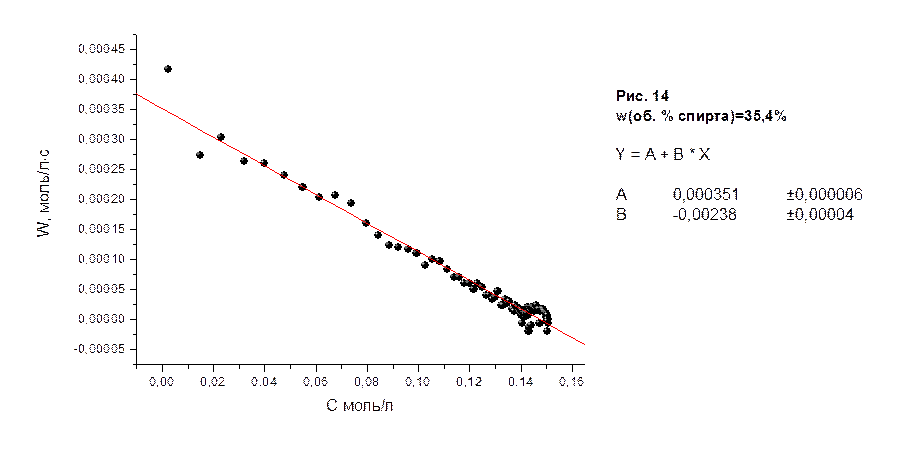
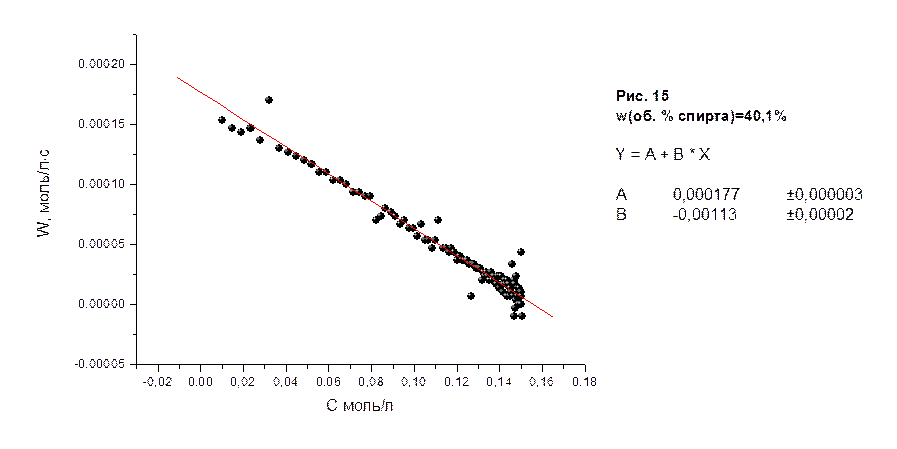
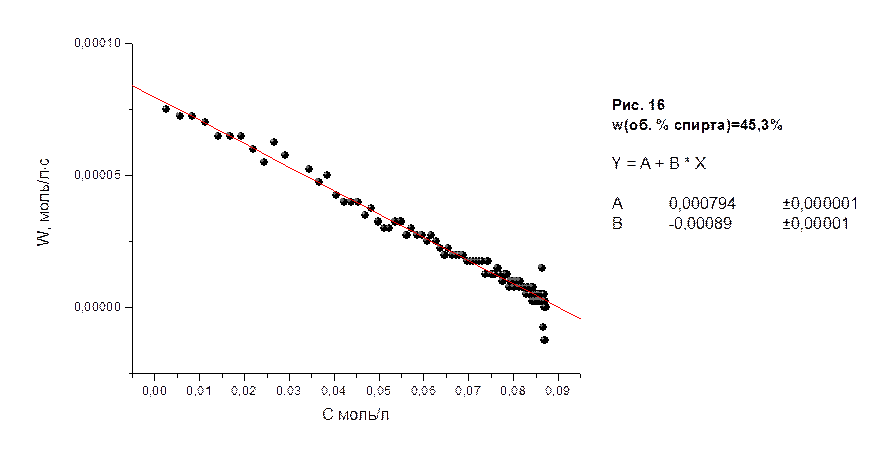
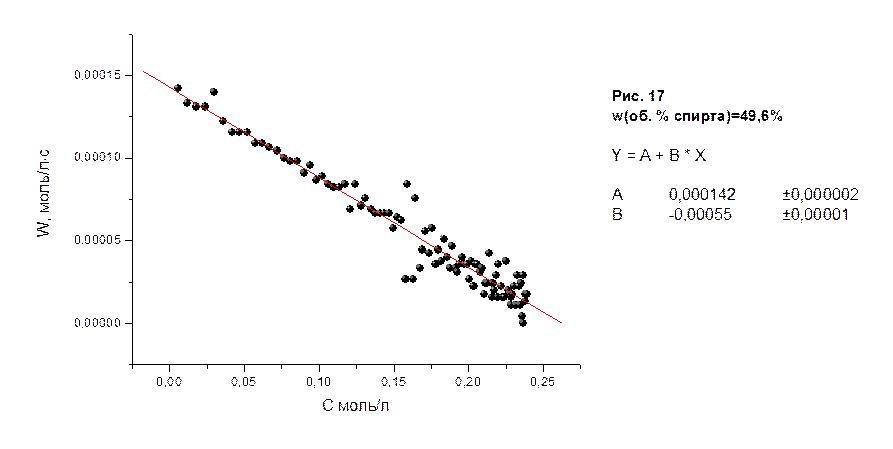
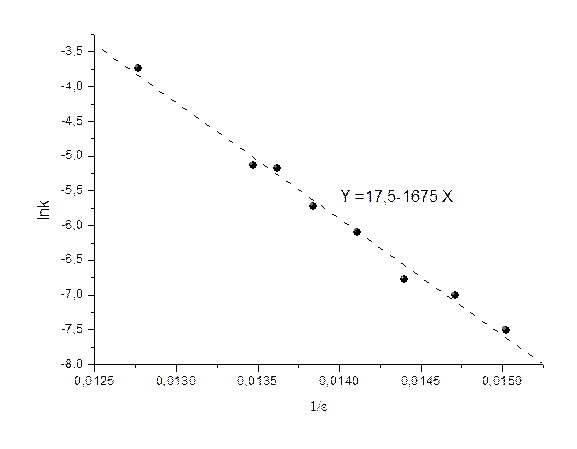
Рис. 19. Зависимость lnk константы скорости сольволиза трет-бутилхлорида
от 1/ε.
6. Список литературы.
1. Эммануэль Н.М., Кнорре Д.Г. Курс химической кинетики. – М.: Высшая школа, 1984. – 463 с.
2. Пальм В. А. Основы количественно теории органических реакций. – М.: Химия, 1977. – 360 с.
3. Гаммет Л. Основы физической органической химии. – М.: Мир, 1972. – 527 с.
4. Замараев К.И. Химическая кинетика: Курс лекций: в 3 ч. / Под ред. А. Г. Окунева, К. П. Брылякова; Новосиб. гос. ун-т. Новосибирск, 2004. Ч.2. 102 с
5. Никольский Б.П. Справочник химика. – М.: Химия, 1965. Т.3. 1008 с.
6. Ахадов А. Ю. Диэлектрические свойства бинарных растворов. – М.: Наука, 1977. – 399 с.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.