Новосибирский государственный университет
Отчет по лабораторной работе С-2
Тема: ОПРЕДЕЛЕНИЕ КОНСТАНТЫ ДИССОЦИАЦИИ
МЕТИЛОВОГО ОРАНЖЕВОГО ПО СПЕКТРОСКОПИЧЕСКИМ ДАННЫМ
Выполнили: |
Шамрэтт И.А. |
|
Матяж Д.Н. |
|
|
студенты 642 группы |
|
Преподаватель: |
Арзуманов С. С. |
Новосибирск 2008
Цель лабораторной работы:
– регистрация спектров поглощения растворов метилового оранжевого с различными значениями pH в видимой и ультрафиолетовой областях спектра;
– определение рабочих длин волн для кислой и основной форм исследуемого индикатора, нахождение изобестической точки;
– проверка закона Бугера–Ламберта–Бэра. Определение коэффициентов экстинкции кислой и основной форм индикатора на выбранных длинах волн;
– определение константы диссоциации метилового оранжевого.
Теоретическая часть.
В данной работе исследуется кислотно-основное равновесие, устанавливающееся в растворах метилового оранжевого (натриевой соли 4'-диметиламиноазабензол-4-сульфокислоты).
Схематично процесс диссоциации, протекающий в растворе данного индикатора, можно представить следующим уравнением:
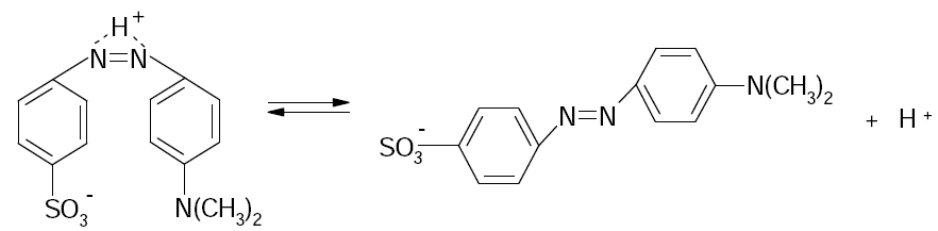
Метиловый оранжевый относится к амфотерным индикаторам, т. к. его молекула содержит одновременно кислотную и основную группы. Кроме того, кислотно-основная диссоциация в этой молекуле сопровождается цис-транс изомерным переходом.
В случае достаточно разбавленных растворов константа диссоциации индикатора связана с его степенью диссоциации a и с рН раствора соотношением (1).
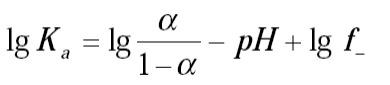 (1)
(1)
Значение степени диссоциации находится из измерений оптической плотности растворов индикатора в буфере с известным значением рН по формуле (2).
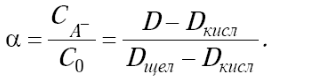 (2)
(2)
Для этого же раствора по формуле Дебая–Хюккеля (3):
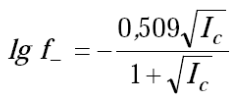 (3)
(3)
определяется коэффициент активности f-. Зная для одного и того же раствора значения α, рН и f-, можно определить значение константы диссоциации Kа.
Однако для точного определения Ка необходимо выполнение следующих условий:
– концентрация индикатора в кислых, щелочных и буферных растворах должна быть выбрана так, чтобы максимальные значения оптических плотностей всех растворов находились в пределах рабочей шкалы используемых приборов (0,1 < D < 1,4);
– поскольку значения коэффициентов экстинкции исследуемых частиц могут зависеть от ионной силы раствора, все используемые растворы должны иметь одинаковую ионную силу Iс . (4)
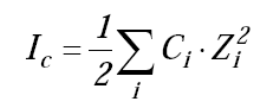 (4)
(4)
,где Iс – ионная сила раствора; Сi и Zi– молярная концентрацияи заряд иона; при этом суммирование производится по всемприсутствующим в растворе ионам. Обычно концентрации реагентов, образующих буферный раствор, значительно превышают концентрации исследуемых веществ.
Кроме того, значения Iс не должны превышать 0,01 М, чтобы для расчета коэффициентов активности ионов можно было использовать формулу Дебая–Хюккеля;
– все эксперименты должны выполняться при одинаковой температуре, поскольку коэффициент экстинкции зависит от температуры.
Экспериментальная часть.
Приготовление растворов.
Исходные готовые водные растворы приготовлены лаборантом и имеют следующие концентрации:
|
Растворенное вещество |
Концентрация |
|
Метиловый оранжевый |
1 г/л |
|
HCl |
0,1 М |
|
NaOH |
0,1 М |
|
СН3СООН |
0,3 М |
Буферный раствор I (буфер I), pH = 3,9, готовим в мерной колбе на 200 мл из ацетата натрия и уксусной кислоты. Для этого рассчитываем необходимую навеску дигидрата ацетата натрия, чтобы концентрация ацетата натрия в готовом буферном растворе была равна 0,02 М.
Необходимое количество уксусной кислоты рассчитываем по формуле Гендерсона (5):
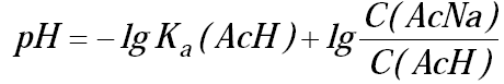 (5)
(5)
Ка (АсH) = 1,75·10-5.
На откалиброванном иономере «Анион-4100» корректируем значение рН приготовленного буфера I, добавляя в него ацетат натрия или уксусную кислоту.
Буфер II (pH = 3,7) и буфер III (pH = 3,5) готовим из буфера I в стаканчиках на 50 мл, добавляя по каплям уксусную кислоту. Значение pH контролируем по иономеру.
Раствор метилового оранжевого с концентрацией 0,2 г/л готовим в мерной колбе объемом 50 мл. c=6,58*10-4 м
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.