Цель работы:
1. Определение константы равновесия гомогенной реакции от температуры.
2. Ознакомление с расчетом термодинамических функций по константе химического равновесия.
Теоретическая часть.
Зависимость константы химического равновесия от температуры выводится, во-первых, из уравнения нормального химического сродства - изотермы Вант - Гоффа:
DG° = A p = RT In K p (2.1)
и, во - вторых, из уравненияГиббса - Гельмголбца:
DG°T = DH°T - TDS°; (2.2)
DG°T = DH°T +T *
(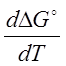 ) (2.3)
) (2.3)
удобно сочетающих первый и второй законы термодинамики применительно к обратимым изотермическим процессам, где
DH°T - стандартный тепловой эффект реакции;
DS°- стандартное изменение энтропии.
Для нахождения зависимости константы химического равновесия от температуры возьмем производную по температуре от уравнения изотермы (2.1):
- (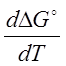 )р
= RinKp + RT
)р
= RinKp + RT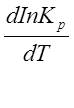 (2.4)
(2.4)
Подставив значения DG ( 2.1) и ее производной по температуре (2.4) в уравнение ( 2.3), получим:
- RTInKp = DH° - RTInKp – RT2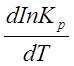 (2.5)
(2.5)
или после преобразования:
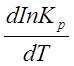 =
= 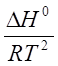 (2.6)
(2.6)
где 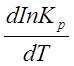 - температурный коэффициент константы химического
равновесия.
- температурный коэффициент константы химического
равновесия.
Выражение (2.6.) называется уравнением изобары Вант - Гоффа. Если процесс протекает в постоянном объеме, то зависимость константы равновесия от температуры определяется уравнением изохоры Вант - Гоффа, которое выводится аналогично:
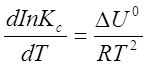 (2.7)
(2.7)
где DU - стандартное изменение внутренней энергии системы.
Для реакций, протекающих в неидеальных растворах, в уравнении изохоры Ксзаменяется на Ка (с - концентрация заменяется активностью а):
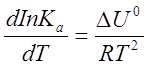 (2.8)
(2.8)
Уравнения (2.6), (2.7) и (2.8) показывают, если реакция протекает с выделением тепла DH < 0, DU < 0), то
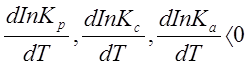 .
.
Следовательно, с повышением температуры константа равновесия уменьшается и равновесие смещается в сторону обратной реакции. Поэтому экзотермические реакции необходимо проводить при пониженной, а эндотермические - при повышенной температуре.
Уравнения изобары (2.6) и изохоры (2.7 и 2.8) определяют зависимость констант равновесия от температуры в дифференциальном виде. Для практических расчетов характеристик равновесий следует проинтегрировать эти уравнения в пределах двух температур с учетом, что тепловой эффект реакции DH в небольшом температурном интервале изменяется незначительно и его можно считать постоянным. При таком допуске интегрирование уравнения (2.6) приводит к выражению:
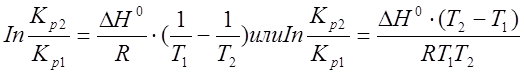 (2.9)
(2.9)
Это уравнение позволяет,
во - первых, вычислить стандартный тепловой эффект реакции DH0 по экспериментально найденным при двух температурах константам равновесия; во - вторых, вычислить константу равновесия при заданной температуре, если известный стандартный тепловой эффект реакции и константа равновесия при другой температуре.
Точное значение теплового эффекта реакции, учитывающее его зависимость от температуры Т, рассчитывается по закону Кирхгофа:
DH0г
= DH0298 + 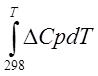 (2.10)
(2.10)
где DH0298 определяют по стандартным теплотам образования;
DСр - изменение теплоемкости веществ в процессе реакции.
Неопределенный интеграл уравнения изобары Вант - Гоффа (2.6) дает:
InKp = - 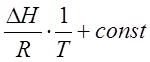 (2.11)
(2.11)
При переходе к десятичному логарифму получим
IgKp=
- 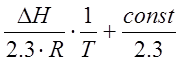 (2.12)
(2.12)
Обозначим постоянные .слагаемые буквами А и В, тогда уравнение (2.12) примет вид
IgKp = 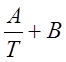 (2.13)
(2.13)
Выражения (2.12) и (2.13) удобны для графического анализа процессов, так как зависимость в координатах lgKp=f(1/T) представляет собой прямую линию, где
А=- 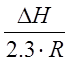 - угловой коэффициент прямой;
- угловой коэффициент прямой;
B = 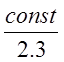 отрезок абсциссы, отсекаемой этой
прямой и равный IgKp при 1/T= 0.
отрезок абсциссы, отсекаемой этой
прямой и равный IgKp при 1/T= 0.
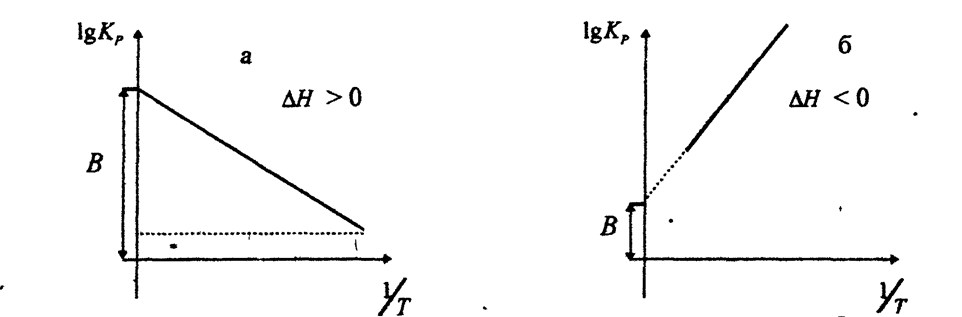
Рис.1. Зависимость логарифма константы равновесия от величины обратной температуры.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.