ЦЕЛЬ РАБОТЫ:
Содержание работы
Изучение взаимной растворимости жидкостей показало, что не вое жидкости могут в одинаковой степени смешиваться друг с другом. Ограниченная растворимость наблюдается в том случае, если переход молекул через поверхность раздела сопряжен с совершением работы, заметно превышающей среднюю энергию движения молекул жидкостей при данных условиях. Чем больше будет работе перехода, тем меньше будет молекул, способных осуществить эту работу, и тем меньше будет растворимость одной жидкости в другой. Величина работы перехода, а следовательно, и растворимость компонентов зависят от их интенсивности межмолекулярных взаимодействий.
Давление пара над идеальным раствором подчиняется закону Рауля, согласно которому парциальное давление пара компонента над раствором равно произведению давления пара чистого компонента на его мольную долю в растворе.
PA = PA0 * NA , (1)
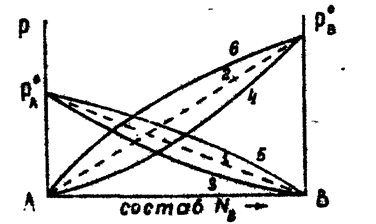 |
отвечающее уравнению прямой (рис.1)
Рис. 1. Давление пара системы А - В
1 - 2 - изменение парциальных давлений компонентов А и В для случаям образования ими идеальных растворов. 3 - 4 - изменение парциальных давлений компонентов А и В для случая отрицательных отклонений их от закона Рауля.
5 - 6 - изменение парциальных давлений компонентов А и В для случая положительных отклонений их от Закона Рауля.
Отклонения от идеальности обусловлены как физическими, так и химическими причинами (дипольные взаимодействия, поляризация, различная интенсивность ван-дер-ваальсовых сил, ассоциация, диссоциация, сольватация и др.). Все эти взаимодействия настолько переплетаются, что трудно предугадать суммарный результат. Однако благодаря преобладанию одной из форм взаимодействия, можно произвести классификацию растворов по признаку отрицательного или положительного отклонения от законов Рауля. Если силы взаимодействия между однородными частичками А - А и В - В меньше, чем разнородными А - В, то есть, FA-A < FA-B> FB-B то имеется стремление к взаимодействию компонентов, которое вызывает повышение растворимости. Образование раствора ' сопровождается выделением тепла. Поэтому теплота парообразования компонента из раствора оказывается большей, чем чистого компонента. Затруднение парообразования означает понижение давления пара. В этом случае говорят об отрицательном отклонении от закона Рауля (рис.1,кривые 3-4). Образования раствора, как правило, сопровождается уменьшением объема. Если силы взаимодействия между однородными частичками А - А и В - В больше, чем разнородными А - В, т.е. если FA-A < FA-B> FB-B , то процесс растворения сопровождается поглощением тепла. Это приводи к уменьшению теплоты парообразования, т.е. облегчает испарение. Если одинаковые молекулы стремятся к ассоциации, то растворимость, по сравнению с идеальной (рассчитанной по закону Рауля), понижается. Образование раствора, как правило, сопровождается увеличением объема. В этом случае говорят о положительном отклонении от закона Рауля (рис.1, кривые 5,6).
Весьма значительное положительное отклонение от закона Рауля приводит к нарушению гомогенности - обе жидкости оказываются растворимыми до определенного предела.
При очень больших положительных отклонениях от закона Рауля бинарные смеси образуют гомогенную систему только в определенных соотношениях. Добавление первой жидкости ко второй при постоянной температуре до определенной концентрации вызывает образование насыщенного раствора первого компонента. То же наблюдается при добавлении второй жидкости к первой. Таким образом, смещение двух жидкостей в любых соотношениях с образованием насыщенных растворов дает трехфазную равновесную систему, состоящую из двух несмешивающихся равновесных растворов и насыщенного пара над ними постоянного состава. Такие системы характеризуются равенством химических потенциалов каждого компонента во всех фазах.
Основные закономерности в отношении взаимной растворимости веществ были установлены Алексеевым. Область сосуществования двух жидких фаз при различных температурах можно представить в виде зависимости температуры растворения от состава насыщения растворов при постоянном давлении на примере системы фенол-вода или анилин-вода (рис 1). При температуре t1 точки Q и K , соединенные коннодой, отвечают составу равновесных иди сопряженных
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.