![]()
т.е. в этом случае степень диссоциации обратно пропорциональна корню квадратному из концентрации раствора.
§ 3. Законы электролиза Фарадея
Закон электролитической проводимости был эксперимента-льно установлен Фарадеем в 1836 году.
Пусть в сосуд налит водный раствор медного купороса CuSO4 и в него опущены два электрода: К – угольный и А –
мед-ный. К электродам присоединена батарея, причём угольный элек-трод К
соединён с отрицательным полюсом батареи, а медный электрод А – с
положительным. Тогда между электродами в ![]() растворе
образуется электрическое поле. Под влиянием этого поля ионы начут двигаться.
Через раствор пойдёт электрический ток.
растворе
образуется электрическое поле. Под влиянием этого поля ионы начут двигаться.
Через раствор пойдёт электрический ток.
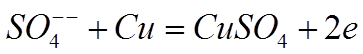
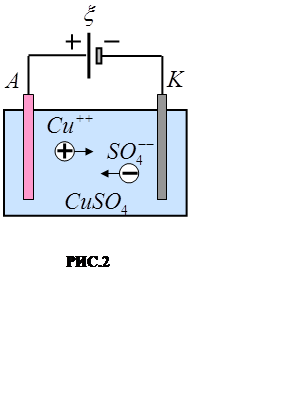 Положительные
ионы меди Cu++ дви-жутся к катоду и там выделяются в качестве атомов
меди. Отрицательные ионы
Положительные
ионы меди Cu++ дви-жутся к катоду и там выделяются в качестве атомов
меди. Отрицательные ионы 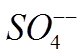 движутся к аноду. Нейтрали-зовавшись у
анода, ионы
движутся к аноду. Нейтрали-зовавшись у
анода, ионы 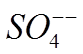 вступают
с ним в химическую реакцию и образуют вновь молекулы медного купороса
вступают
с ним в химическую реакцию и образуют вновь молекулы медного купороса
где е – электрон, перешедший на анод. Эти образовавшиеся молекулы медного купороса снова переходят в раствор.
В результате количество медного купороса в растворе остаётся неизменным: на катоде выделяется медь, а медь с анода, вступая в химическую реакцию с ионом SO4 переходит в раствор.
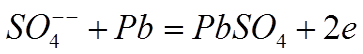 Этот пример
показывает, что с одной стороны, проводимость электролита обусловлена движением
ионов, на которые диссоциированы молекулы растворённого вещества, а с другой –
что на электродах не обязательно выделяются составные части растворённого
вещества. Конечный результат электролиза зависит от химических реакций, оторые
происходят в местах выделения ионов. Эти реакции называют вторичными. Очевидно,
Этот пример
показывает, что с одной стороны, проводимость электролита обусловлена движением
ионов, на которые диссоциированы молекулы растворённого вещества, а с другой –
что на электродах не обязательно выделяются составные части растворённого
вещества. Конечный результат электролиза зависит от химических реакций, оторые
происходят в местах выделения ионов. Эти реакции называют вторичными. Очевидно,
![]() что характер вторичных реакций определяется
не только природой раствора, но и материалом из которого сделаны электроды. Так
при электролизе водного раствора серной кислоты H2SO4 в случае свинцовых электродов на катоде выделяется
газообразный водород, а на аноде начинает выделяться ион
что характер вторичных реакций определяется
не только природой раствора, но и материалом из которого сделаны электроды. Так
при электролизе водного раствора серной кислоты H2SO4 в случае свинцовых электродов на катоде выделяется
газообразный водород, а на аноде начинает выделяться ион 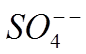 , который вступая в реакцию с материалом анода,
образует сульфат свинца
, который вступая в реакцию с материалом анода,
образует сульфат свинца
![]()
В случае платиновых электродов на катоде попрежнему
выделяться газообразный водород. Ион же 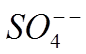 ,
выделяющий-ся у анода, не вступает в реакцию с платиной, а вступает в реакцию с
водой, причём оеакция будет протекать в виде
,
выделяющий-ся у анода, не вступает в реакцию с платиной, а вступает в реакцию с
водой, причём оеакция будет протекать в виде
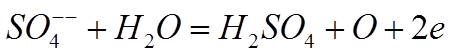
![]()
т.е. вновь образуется серная кислота, а у анода выделяется газообразный кислород.
Первый закон Фарадея относится к связи между количеством выделяющегося на электроде вещества, силой тока и временем его прохождения через электролит. Этот закон имеет следующую формулировку: масса выделевшегося на электроде вещества пропорциональна силе тока и времени его прохождения
где k– коэффициент пропорциональности, зависящий только от рода выделяющегося вещества (состава электролита).
Заменяя I t = Q , получим
т.е. масса выделившегося вещества пропорциональна прошедшему через электролит количеству электричества. Коэффициент k называется электрохимическим эквивалентом выделяемого вещества.
Т.к. при Q = 1 численно имеем M = k , то, следовательно, электрохимический эквивалент численно равен массе вещест-ва, выделяющегося при прохождении через электролит едини-цы количества электричества. Из этого следует, что электрохимический эквивалент имеет размерность кг / Кл .
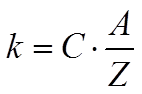 Второй
закон Фарадея утверждает, что электрохимичес-кий
эквивалент пропорционален химическому эквиваленту данного вещества
Второй
закон Фарадея утверждает, что электрохимичес-кий
эквивалент пропорционален химическому эквиваленту данного вещества
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.