В действительности процесс диссоциации носит более слож-ный характер, так как возникающие ионы взаимодействуют с мо-лекулами воды. Например, в случае водного раствора ион Н+ не остаётся в свободном состоянии (свободный протон), а соединяе-тся с молекулой воды, образуя молекулярный положительный ион Н3О+ (ион гидроксония), при растворении медных солей об-разуются группы Cu(H2O)4++ и т.д.. Такие процессы называются гидратацией, если в качестве растворителя выступает вода, или в общем случае – сольватацией.
Итак, полярные молекулы диссоциируют в растворе под влиянием полярных молекул растворителя. Степень диссоциации зависит от природы молекул как растворённого вещества так и растворителя. Имеется параллелизм между диэлектрической проницаемостью вещества и его способностью вызывать диссо-циацию: чем больше диэлектрическая проницаемость раствори-теля, тем большуу степень диссоциации он вызывает. Вода зани-мает исключительное место среди растворителей, являясь лучшим растворителем электролитов. Остальные растворители, особенно органические, плохо растворяют электролиты. Для сравнения ниже приводятся значения относительной диэлектрической проницаемости для наиболее широко применя-емых растворителей:
1. Цианисто-водородная кислота ………96
2. Вода ……………………………………80
3. Муравьиная кислота ………………….62
4. Этиловый спирт ……………………….25
5. Диэтиловый эфир ……………………..4,1
6. Бензол ………………………………….2,3
§ 2. Закон разведения Оствальда
Для количественной характеристики степени диссоциации вводится в рассмотрение коэффициент диссоциации α.
Предположим, что в единице объёма раствора имеется no молекул растворённого вещества, из которых n/ o= αno диссоции-рованы на ионы, а n//o= no - αno=(1-α)no не диссоциированы. Коэффициент диссоциации α указывает степень диссоциации молекул в растворе. Очевидно, что если α = 1 , то все молекулы диссоциированы, а если α = 0 , то диссоциация отсутствует. По данной степени диссоциации раствора мы имеем дело с подвиж-ным (динамическим) равновесием, при котором число элементар-ных актов диссоциации в единицу времени равно числу актов ре-комбинации.
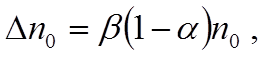 Число новых
пар ионов, возникающих в единицу времени в единице объёма, пропорционально
числу наличных молекул, следовательно
Число новых
пар ионов, возникающих в единицу времени в единице объёма, пропорционально
числу наличных молекул, следовательно
где β – коэффициент пропорциональности.
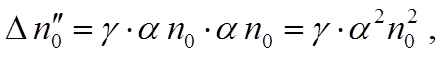 Число ионов,
воссоединяющихся в молекулы, пропорциона-льно как числу положительных, так и
числу отрицательных ионов. Так как число ионов каждого знака в единице объёма
рав-но αno то,
следовательно, число пар ионов, воссоединяющихся в единице объёма в единицу
времени можно считать равным
Число ионов,
воссоединяющихся в молекулы, пропорциона-льно как числу положительных, так и
числу отрицательных ионов. Так как число ионов каждого знака в единице объёма
рав-но αno то,
следовательно, число пар ионов, воссоединяющихся в единице объёма в единицу
времени можно считать равным
где
![]() - коэффициент пропорциональности.
- коэффициент пропорциональности.
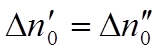 Условие
равновесия между процессом диссоциации и процессом рекомбинации, очевидно,
сводится к тому, чтобы чис-ло вновь образующихся пар ионов равнялось числу
воссоединяю-щихся пар ионов, т.е. чтобы
Условие
равновесия между процессом диссоциации и процессом рекомбинации, очевидно,
сводится к тому, чтобы чис-ло вновь образующихся пар ионов равнялось числу
воссоединяю-щихся пар ионов, т.е. чтобы
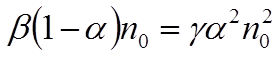 или
или
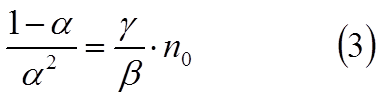 Из последнего
равенства находим
Из последнего
равенства находим
Полученная формула выражает закон Оствальда, показыва-ющий как зависит коэффициент диссоциации α от концентрации раствора no. Отношение коэффициентов α / β не зависит от no, а зависит от природы раствора и тех условий (температуры), при которых он находится.
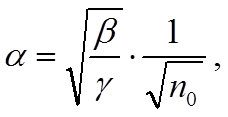 Формула
(3) позволяет сделать некоторые выводы о степени диссоциации молекул в
растворе. Если раствор слабый, т.е. no=0 то α близко к единице, что означает –
практически все молекулы растворённого вещества диссоциированы. Если
предположить, что степень диссоциации мала, то в равенстве (3) можно
пренеб-речь в числителе коэффициентом α по сравнению с
единицей, тогда получим
Формула
(3) позволяет сделать некоторые выводы о степени диссоциации молекул в
растворе. Если раствор слабый, т.е. no=0 то α близко к единице, что означает –
практически все молекулы растворённого вещества диссоциированы. Если
предположить, что степень диссоциации мала, то в равенстве (3) можно
пренеб-речь в числителе коэффициентом α по сравнению с
единицей, тогда получим
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.