Министерство образования Российской Федерации

ХАБАРОВСКИЙ
ГОСУДАРСТВЕННЫЙ
ЛАБОРАТОРНЫЙ
ПО ЭКСПЕРИМЕНТАЛЬНОЙ
ФИЗИКЕ
 |
|||
ЭЛЕКТРИЧЕСТВО И МАГНЕТИЗМ
«ОПРЕДЕЛЕНИЕ
ЭЛЕКТРОХИМИЧЕСКОГО ЭКВИВАЛЕНТА
ВЕЩЕСТВА, ЗАРЯДА ИОНА И ЧИСЛА ФАРАДЕЯ»
 |
Хабаровск 2000
ВВЕДЕНИЕ
Электрические проводники бывают двух типов: металличес-кие или электронные проводники, и электролиты. Перенос электричества в электролитах осуществляется ионами. Ионы представляют собой атомы или группы атомов, которые отдали или присоединили электроны, в результате чего приобрели поло-жительный или отрицательный заряд.
Явление выделения током химических составных частей про-водника получило название электролиза (от греческого лио – разлагаю). Электролиз имеет место не во всех проводниках. Про-водники, в которых не наблюдается химического действия тока, называются проводниками первого рода. К их числу принадле-жат все металлы и уголь. Проводники, в которых происходит эле-ктролиз, называются проводниками второго рода или электро-литами. Электролитами являются многие водные растворы кислот и солей и некоторые химические соединения, как в твёр-дом, так и в жидком состоянии.
§ 1. Электролитическая
диссоциация
Электролиты обладают ионной проводимостью, т.е. пере-нос электричества осуществляется ионами, но в отличие от газов (самостоятельные газовые разряды), где ионы образуются под действием самого тока, в электролитах ионы существуют незави-симо от тока. Это подтверждает тот факт, что для электролитов хорошо выполняется закон Джоуля-Ленца, т.е. вся работа элект-рического тока целиком превращается в тепло и, следовательно, расщепление молекул на ионы происходит не за счёт энергии электрического тока.
Молекулы растворённого в жидкости вещества распадаются (диссоциируют) на заряженные части даже в отсутствие тока под влиянием процессов, происходящих в самом растворе. Это представление лежит в основе теории электролитической дис-социации, заложенной в трудах Клаузиуса и Аррениуса (1887 г).
Совершенно чистая вода очень слабо проводит ток. При раст-ворении в воде ряда веществ, например, сахара, глицерина и т.п., получающийся раствор также не проводит электрический ток. Эти растворы обнаруживают осмотическое давление, величина которого хорошо определяется по формуле Вант-Гоффа. Согласно закону Вант-Гоффа при малой концентрации растворов осмотическое давление подчиняется тем же законам, что и давление идеального газа, т.е.
 |
Поэтому, измеряя осмотическое давление, можно определить и число частиц в каждом кубическом сантиметре раствора. Концентрацию растворённых молекул можно выразить так
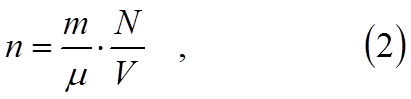 |
где m – масса растворённого вещества, μ – молекулярная масса вещества, V – объём раствора, N– число Авогадро (число моле-кул в грамм-атоме вещества).
Опыт показывает, что если мы имеем дело с раствоами, кото-рые не являются электролитами, то концентрация частиц n1 , оп-ределённая из измерений осмотического давления всегда равна концентрации n , вычисленной по формуле (2). Для электроли-тов опыт всегда даёт число n1 большее числа концентрации рас-творённых молекул n , что и доказывает диссоциацию молекул в электролитах.
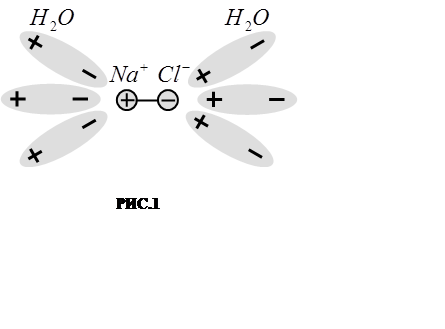
Процесс диссоциации можно представить следующим обра-зом. Пусть какое-либо вещество, обладающее полярными моле-кулами, например NaCl, растворено в воде. Молекулы воды, обладающие большим дипольным моментом (тоже полярные), будут ориентироваться в электрическом поле растворённой молекулы таким образом, что их положительный полюс окажется преимущественно обращённым к иону Cl- , а отрицательная сто-рона (ион О- ) – к иону Na+ (как показано на РИС.1). Это приво-дит к ослаблению связи ионов Na+Cl-в молекуле.
 Сила
взаимного притяже-ния ионов в молекуле NaCl ос-лабляется
в ε раз (ε – диэлект-рическая проницаемость раст-ворителя. Но
молекулы, участ-вуя в тепловом движении, испытывают непрерывные соу-дарения.
Поэтому при встрече с достаточно быстрой молекулой растворителя (или другой
молекулой растворённого вещества) молекула NaCl может
распасться (диссоциировать) на ионы Na+ и Cl- .
Сила
взаимного притяже-ния ионов в молекуле NaCl ос-лабляется
в ε раз (ε – диэлект-рическая проницаемость раст-ворителя. Но
молекулы, участ-вуя в тепловом движении, испытывают непрерывные соу-дарения.
Поэтому при встрече с достаточно быстрой молекулой растворителя (или другой
молекулой растворённого вещества) молекула NaCl может
распасться (диссоциировать) на ионы Na+ и Cl- .
Наряду с рассмотренными актами диссоциации возможны и обратные процессы, когда при соударении двух разноимённых ионов они воссоединяются в нейтральные молекулы NaCl. Такой процесс называется рекомбинацией ионов.
![]() Уравнение,
по которому диссоциируют молекулы NaCl, может быть записано так
Уравнение,
по которому диссоциируют молекулы NaCl, может быть записано так
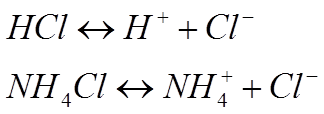 В качестве
примера можно привести такие реакции диссоциации молекул
В качестве
примера можно привести такие реакции диссоциации молекул
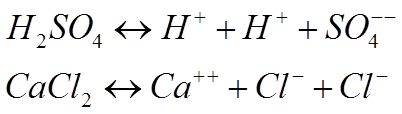 Такие электролиты называются бинарными,
т.е. при растворении дают два иона. Электролиты, при растворении которых
получает-ся три иона, называются тернарными
Такие электролиты называются бинарными,
т.е. при растворении дают два иона. Электролиты, при растворении которых
получает-ся три иона, называются тернарными
Анализ этих и других случаев диссоциации показывает, что при диссоциации металлы и водород всегда образуют положи-тельные ионы или катионы. Остальные части молекул (радика-лы, галогены) образуют отрицательные ионы – анионы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.