10. Зарисовать фрагменты схем энергетических уровней инертных газов и указать в них наблюдаемые в спектрах электронные переходы.
11. Изучить следующие вопросы:
· Электронная конфигурация основного и возбужденных состояний атомов инертных газов.
· Спин-орбитальное взаимодействие в атомах инертных газов и его проявление в спектрах.
· Векторная модель атомов инертных газов.
· Термы инертных атомов, закономерность их расположения в шкале энергии.
Спектры атомов инертных газов представляют собой особый случай. Атомы инертных газов в основном состоянии имеют электронную конфигурацию np6.. Главное квантовое число nпринимает значения: n= 2 (для Ne), : n= 3 (для Ar), : n= 4 (для Kr), : n= 5 (для Xe), : n= 6 (для Rn). Так же, как и для любых других атомов с заполненными оболочками, основным состоянием атомов инертных газов является состояние 1S0 .В отличие от атомов с заполненной внешней оболочкой ns2 , электроны которой сравнительно легко возбуждаются, для возбуждения одного из p-электронов заполненной np6 оболочки требуется значительная затрата энергии – от 21,56 эВ для Ne до 10,74 эВ для Rn. То есть оболочка np6 обладает особой устойчивостью, что и обусловливает химическую неактивность рассматриваемых элементов и их газообразное состояние при обычных температурах. Инертный газ при этом находится в атомарном состоянии.
При возбуждении одного из p -электронов возникают конфигурации типа np5n’l’. Например, для неона с заполненной оболочкой 2p6возможны следующие электронные конфигурации возбужденного атома: 2p53s, 2p54s,…, 2p53p, 2p53p,…., 2p54d, 2p54d,…, . Внешний электрон n’l’ связан гораздо слабее, чем p-электроны остова p5. Этот факт отражен в таблице 1, в которой приведены значения энергии связи наиболее прочно связанных внешних электронов (n+1)s с энергией электронов npв остове np5. Как видно из этой таблицы, даже для Xeэлектрон 6sсвязан в 5,6 раза слабее, чем электрон 5p.
Таблица 1 – Энергия связи W электронов для атомов инертных газов
|
Элемент |
Энергия ионизации, эВ |
электрон (n+1)s |
электрон np |
||
|
(n+1)s |
W, эВ |
Оболоч-ка иона |
W, эВ |
||
Ne |
21,56 |
3s |
4,95 |
2p5 |
41,07 |
|
Ar |
15,76 |
4s |
4,21 |
3p5 |
27,62 |
|
Kr |
14,00 |
5s |
4,09 |
4p5 |
24,56 |
|
Xe |
12,13 |
6s |
3,79 |
5p5 |
21,21 |
Спектр атома инертного газа по своему характеру является
двухэлектронным спектром, так как оболочка np5 , в которой не хватает одного электрона до полного
заполнения, образует, как и один электрон, дублетный терм 2P.
Однако расположение уровней резко отличается от расположения уровней для
двухэлектронной системы при наличии нормальной связи. Спин-орбитальное
взаимодействие спинового момента ![]() и орбитального момента
и орбитального момента ![]() остова настолько значительно, что их
сложение в полный момент остова
остова настолько значительно, что их
сложение в полный момент остова ![]() не нарушается
взаимодействием с внешним электроном. Поэтому не имеет смысла складывать момент
не нарушается
взаимодействием с внешним электроном. Поэтому не имеет смысла складывать момент
![]() с моментом
с моментом ![]() внешнего
электрона в полный орбитальный момент
внешнего
электрона в полный орбитальный момент ![]() согласно
схеме нормальной связи.
согласно
схеме нормальной связи.
Мерой спин-орбитального взаимодействия является дублетное расщепление 2P1/2 - 2P3/2 однократно заряженных ионов инертных газов (см. таблицу 2).
Таблица 2 – Величина дублетного расщепления ![]() (см-1) терма 2P1/2 - 2P3/2 однократно ионизованных атомов
(см-1) терма 2P1/2 - 2P3/2 однократно ионизованных атомов
|
Ион |
|
|
|
|
|
|
782 |
1432 |
5371 |
10537 |
Как видно из этой таблицы, величина дублетного расщепления весьма велика.
В общем случае для внешнего электрона с l¹0 спин-орбитальное взаимодействие невелико и схема нахождения полного момента импульса (j-j) в чистом виде плохо применима.
Исследования спектральных закономерностей для атомов инертных газов показали, что при нахождении полного момента импульса атома необходимо пользоваться следующей схемой:
На первом этапе в соответствии с нормальным типом связи находят суммарный момент импульса для N электронов остова:
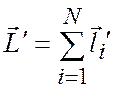 ;
; 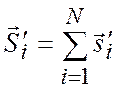 ;
;
![]() ;
;
где
![]() - орбитальный момент i
–го электрона остова,
- орбитальный момент i
–го электрона остова,
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.