4.Заменить ртутную лампу разрядной трубкой, заполненной парами гелия, определить положение спектральных линий гелия относительно шкалы прибора и найти с помощью градуировочного графика их длины волн.
5.С помощью схемы энергетических уровней гелия произвести отнесение его наблюдаемых спектральных линий к спектральным сериям.
6.Определить квантовые дефекты энергетических уровней, относящихся к наблюдаемым сериям и рассчитать энергии последующих трех термов в этих сериях.
Литература
1. Практикум по спектроскопии. Под ред. Л.В. Левшина.
2. Э.В.Шпольский Атомная физика. Т.2.
3. М.А.Ельяшевич. Атомная и молекулярная спектроскопия.
4. С.Э.Фриш. Оптические спектры атомов.
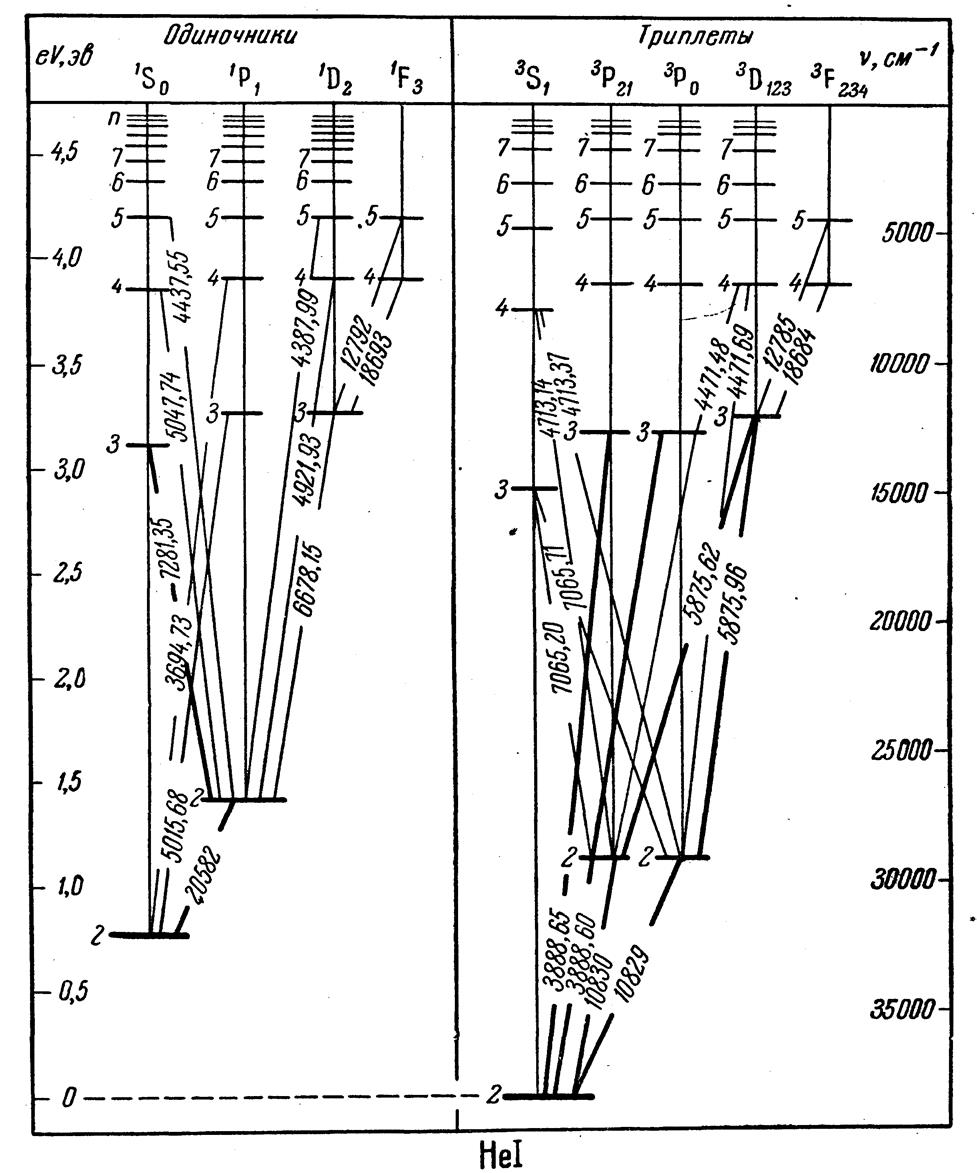
Рисунок Схема переходов в спектре гелия
ИЗУЧЕНИЕ СЕРИАЛЬНОЙ СТРУКТУРЫ СПЕКТРА АЛЮМИНИЯ
Приборы и оборудование: Спектрограф ИСП-30, спектропроектор ПС-18.
1. Зарегистрировать спектры алюминия и железа.
2. Провести классификацию спектральных линий алюминия по сериям.
3. Определить эффективные квантовые числа и квантовые дефекты верхних уровней серий.
4. Найти пределы серий n¥, n* и D основного терма алюминия. Вычислить потенциал ионизации атома алюминия.
5. Изучить следующие вопросы:
· Модель эффективного ядра, снятие вырождения по орбитальному квантовому числу.
· Уровни энергии и спектр атома алюминия.
· Группировка линий в серии и вычисление квантовых дефектов.
Алюминий (Z=13) располагается в Ш группе периодической системы элементов Д.И. Менделеева. В нормальном (невозбужденном) состоянии электронная конфигурация атома Аl имеет вид 1s22s22p63s23p. Подавляющее большинство возбужденных уровней алюминия обусловлено переходами наиболее слабо связанного 3p - электрона, в то время как два 2s - электрона наружного слоя остаются невозбужденными. Электроны 2s - оболочки вместе с электронами внутренних оболочек и ядром атома образуют атомный остаток. Так же как и у щелочных металлов, атомный остаток алюминия составлен из заполненных электронных оболочек, вследствие чего его суммарный орбитальный и спиновой моменты равняются нулю. Поэтому роль атомного остатка алюминия, как и в случае щелочных металлов, сводится к созданию сферически симметричного (центрального) поля, в котором движется оптический (валентный) 3p - электрон. Энергия валентного электрона в центральном поле определяется его главным квантовым числом nи орбитальным квантовым числом l.
Схема термов алюминия состоит из серий дублетных уровней, во многом напоминающих серии щелочных металлов (см. рисунок). Терм уровня по–прежнему может быть выражен формулой
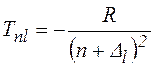 ,
(1)
,
(1)
где
R = 109735 см-1 – постоянная Ридберга, n
– главное квантовое число, ![]() - квантовый дефект –
величина, описывающая экранирующее действие электронов атомного остатка на
валентный электрон и зависящая от орбитального квантового числа l.
- квантовый дефект –
величина, описывающая экранирующее действие электронов атомного остатка на
валентный электрон и зависящая от орбитального квантового числа l.
![]() (2)
(2)
называется эффективным квантовым числом.
Таким образом, модель атома, используемая при рассмотрении спектров щелочных металлов (оптический электрон в поле атомного остатка), в значительной мере остается верной и для более сложного атома алюминия.
При переходах оптического электрона в атоме алюминия возникают следующие основные серии спектральных линий (смотри рисунок):
4 2S – n 2P (n = 4,5,6,….) главная серия
3 2P - n 2D (n = 3,4,5,….) первая побочная серия
3 2P - n2S (n = 4,5,6,….) вторая побочная серия
3 2D- n2F (n= 4,5,6,….) серия Бергмана
Роль главной серии у алюминия играют две побочные серии, которые возникают при переходах на основной терм атома 3 2P . Линии этих серий наиболее интенсивны. Они наблюдаются как в испускании, так и в поглощении.
Мультиплетная структура линий обеих побочных серий обусловлена дублетным расщеплением нижнего 3 2P терма. Поэтому линии имеют вид дублетов, расстояние между компонентами которых, выраженное в частотах, остается постоянным для всех членов серии.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.